业务咨询

![]() 发布时间:2024-03-08
发布时间:2024-03-08
![]() 环特生物
环特生物
![]() 浏览次数:3234
浏览次数:3234

编者按
在美国,胰腺导管癌(PDAC)是第四致死癌症,有癌王之称。大规模基因组研究表明在超过90%的PDAC患者中,都存在着KRAS突变。大量的研究表明KRAS突变在癌症的起始以及进展过程中发挥重要作用,导致癌症的增生、迁移、转化、逃避肿瘤免疫反应以及细胞代谢重编程。
在PDAC中,KRAS蛋白的12号氨基酸最常突变的位点,其中以KRASG12D突变类型最为常见,其次是KRSAG12V。目前针对KRAS突变靶点的药物甚少,主要的药物靶向策略是设计选择性共价抑制剂,其通过与激活状态的KRAS以及青环素A之间形成稳定的、高亲和力的复合物达到抑制效果,但这些药物都尚未使用等基因癌症模型进行验证,对PDAC患者的治疗效果未可知,因此需要寻找新的新的治疗策略以及药物。
今天,我们特别关注美国康奈尔医学院陈水冰教授、Todd Evans教授团队于2023年12月26日发表在《Cell Stem Cell》(IF:23.9)的经典研究——A pancreatic cancer organoid platform identifies an inhibitor specific to mutant KRAS,该研究通过CRISPR/Cas9的技术构建等基因突变胰腺类器官,利用胰腺类器官进行高通量药物筛选研究,最终鉴定出了Perhexiline maleate(马来酸派克西林),它可以在体外以及体内一直携带KRAS突变的胰腺癌类器官以及原代人PDAC类器官的生长并诱导细胞凋亡。同时,研究者发现胆固醇合成在KRAS突变的类器官中特异性上调,Perhexiline maleate可以降低SREBP2的表达水平,从而发挥对KRAS突变体的抑制作用。这一研究为筛选胰腺癌的靶向抑制剂提供了新的研究工具。
论文翻译:唐为东
01、主要研究成果
1、四种等基因突变胰腺类器官构建
研究者采用CRISPR/Cas9的技术构建了四种等基因突变胰腺类器官(KC/KPC/KSC/KPSC),然后采用单细胞测序技术对构建的胰腺类器官进行转录组分析,探究突变引起的转录组变化。
通过无监督数据分析和条形码投影识别的细胞簇匹配良好,这表明细胞簇的基因特征主要受基因型影响。研究者进一步研究了胰腺细胞谱系的转录因子谱,包括导管谱系、外分泌谱系以及内分泌谱系。
结果发现构建的突变胰腺类器官主要是胆管来源的。临床上PDAC主要分为两种亚型:经典样亚型以及基底样亚型,研究者进一步探究了构建类器官所属亚型,结果发现在KPC以及KPSC类器官中,经典样亚型以及基底样亚型共存,而KSC类器官主要以基底样亚型为主。以上结果表明,等基因突变的胰腺类器官具备胰腺癌相关的表型。
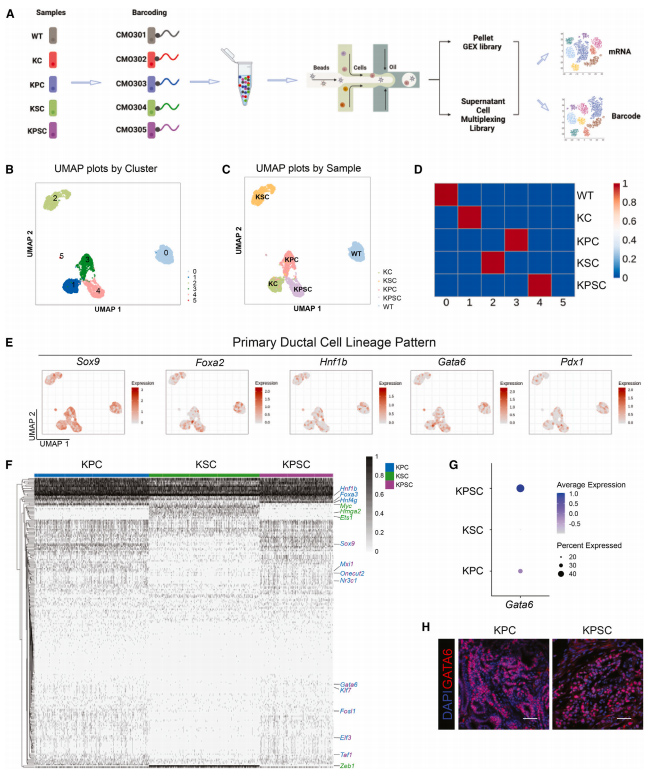
图1
2、建立高通量药物筛选平台,以找到潜在靶向KRAS突变的抑制剂
为了找到潜在靶向KRAS突变的抑制剂,研究者建立了一个高通量药物筛选平台。首先将四种突变类器官接种于384孔板中,然后给予6000种FDA批准的药物、信号通路抑制剂以及天然产物,给药48 h后,采用alamaBlue分析细胞活性,筛选出60种潜在靶向抑制剂。
进一步研究者利用CellTiter-Glo分析细胞死活,从60种抑制剂中筛选出49种抑制剂,其中23种具有量效曲线,进一步发现四个具有良好剂量依赖性以及低毒性的化合物:phehexiline maleate(马来酸派克西林)、gentian violet(结晶紫)、clotrimazol(克霉唑)以及lestaurtinib(来他替尼)。其中结晶紫和克霉唑因为缺乏药效药动数据而不能进行体内分析,而来他替尼在治疗PDAC的临床试验中宣告失败,因此研究者将重点聚焦于phehexiline maleate(马来酸派克西林)上。
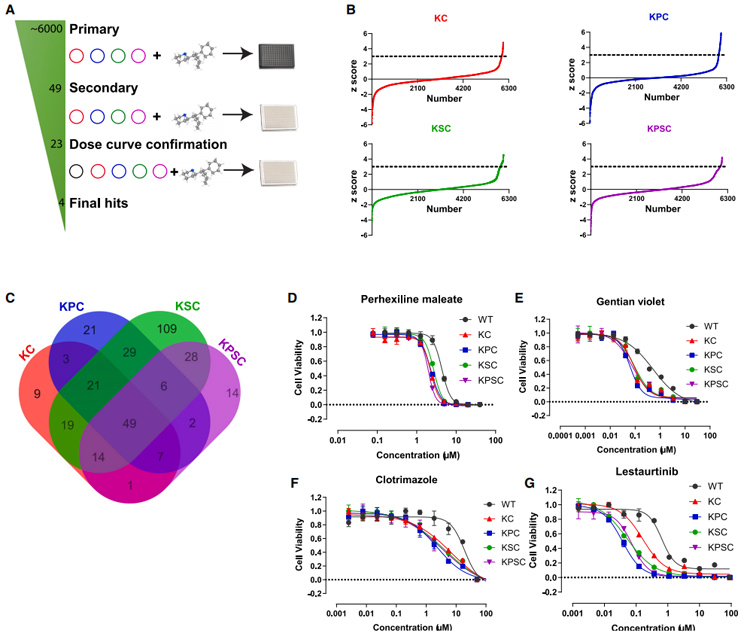
图2
3、明确phehexiline maleate(马来酸派克西林)药效
为了进一步明确phehexiline maleate(马来酸派克西林)的药效,研究者首先在体外给予类器官phehexiline maleate(马来酸派克西林),结果发现突变类器官出现显著死亡,而对照组类器官正常生长,同时免疫荧光结果发现phehexiline maleate(马来酸派克西林)能显著下调类器官Ki67的表达以及上调Caspase-3的表达。
接着,研究者利用小鼠原位移植模型探讨phehexiline maleate(马来酸派克西林)的体内药效,结果表明phehexiline maleate(马来酸派克西林)能明显抑制肿瘤的生长,以上结果表明phehexiline maleate(马来酸派克西林)在体内/体外胰腺癌类器官模型中,可以抑制细胞生长以及诱导细胞凋亡。
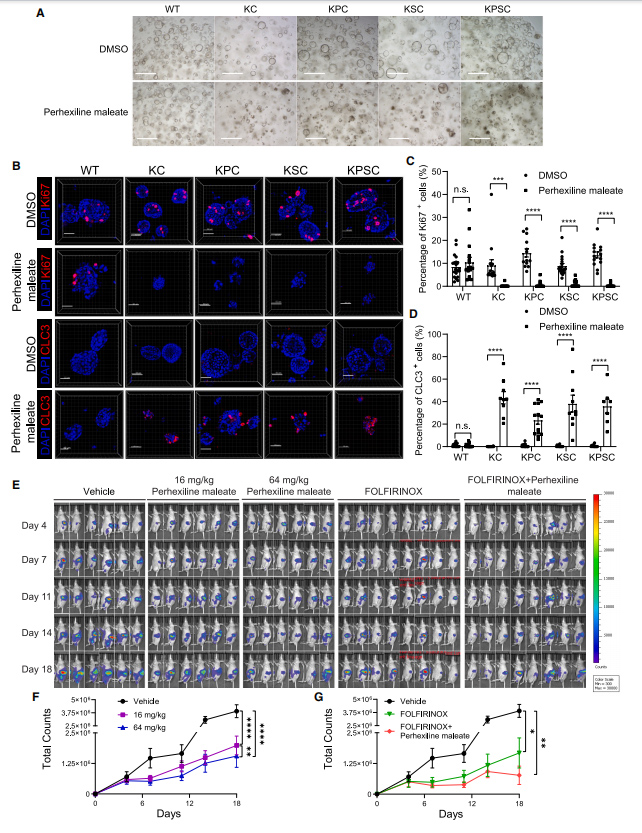
图3
研究者进一步利用PDAC患者来源的胰腺癌类器官来验证phehexiline maleate(马来酸派克西林)的药效,结果发现phehexiline maleate(马来酸派克西林)能明显抑制类器官的生长,同时下调Ki67的表达以及上调Caspase-3的表达,以上结果表明phehexiline maleate(马来酸派克西林)可以抑制PDAC类器官的生长以及诱导细胞凋亡。
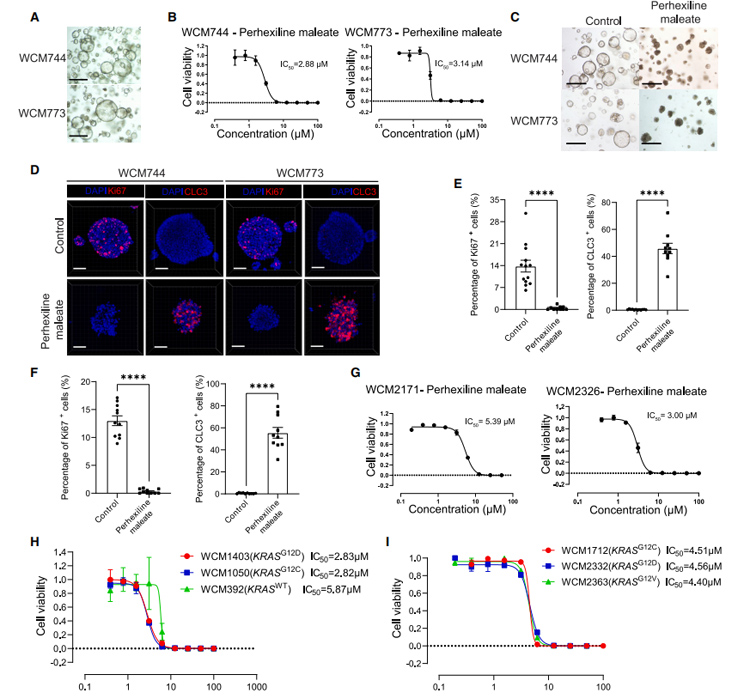
图4
4、进一步探究phehexiline maleate作用机制
为了探究phehexiline maleate(马来酸派克西林)作用的机制,研究者利用基因表达差异分析以及单细胞测序,发现phehexiline maleate(马来酸派克西林)可以下调胆固醇生物合成以及代谢途径相关基因的表达,表达phehexiline maleate(马来酸派克西林)可能是通过抑制胆固醇的合成通路从而发挥药效。
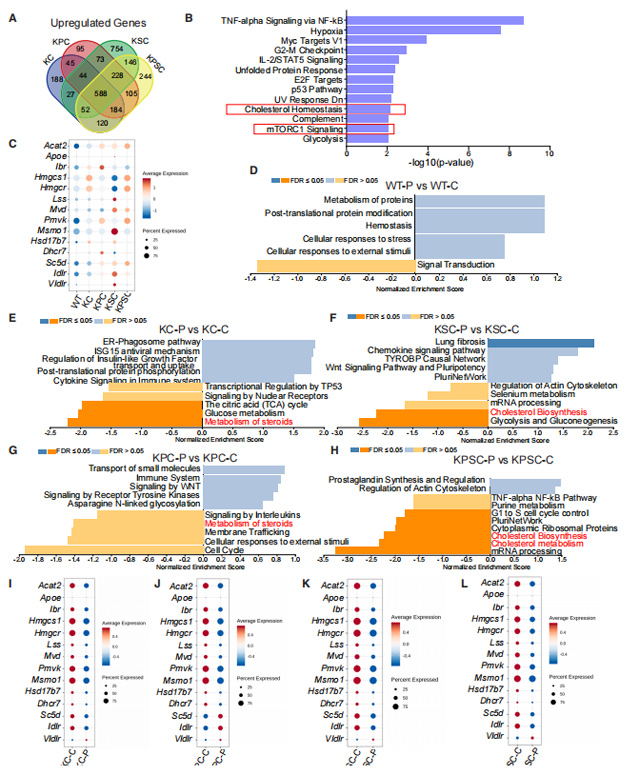
图5
5、突变类器官中Srebf2的作用机制研究
研究表明由Srebf2基因编码的SREBP2蛋白是一个转录因子,通过控制参与胆固醇合成以及摄取的酶从而调控胆固醇稳态。SREBP2提高了胆固醇合成相关基因的表达,为癌细胞的生长提供有利环境,是胶质母细胞瘤、结肠癌以及肝癌的主要驱动因素。
因此,作者想探究phehexiline maleate(马来酸派克西林)调节胆固醇生物合成的效应是否是因为通过调节SREBP2介导的胆固醇生物合成从而发挥作用的。研究者首先发现在突变类器官中Srebf2以及胆固醇摄取基因Ldlr的表达明显上调,而phehexiline maleate(马来酸派克西林)可以明显抑制Srebf2以及胆固醇合成摄取相关基因的表达。研究者进一步通过化学小分子的手段(Betulin)来抑制SREBP2成熟,结果发现Betulin能显著抑制肿瘤的生长。
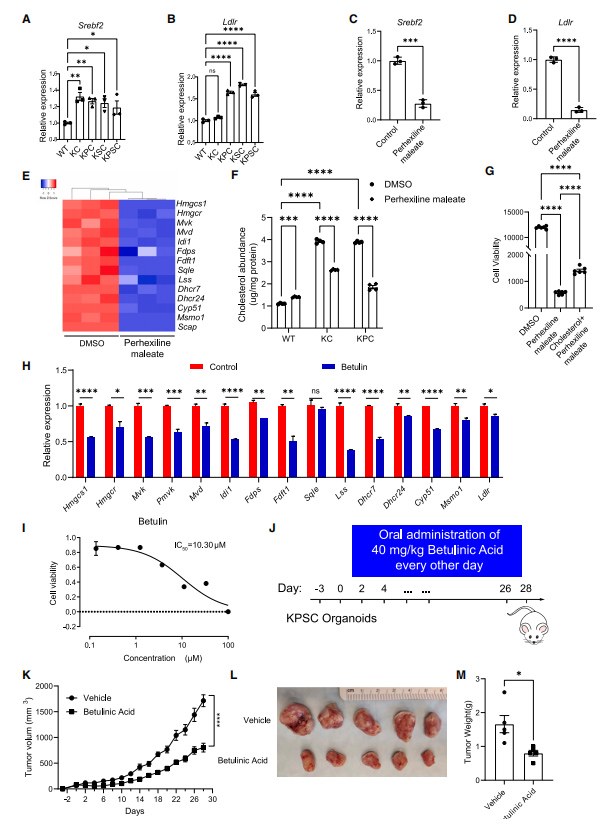
图6
研究者进一步通过遗传学手段,利用shRNA下调Srebf2的表达,结果发现下调Srebf2能显著抑制胆固醇生物合成相关基因的表达以及肿瘤的生长,表明SREBP2是胰腺癌治疗的潜在靶点。
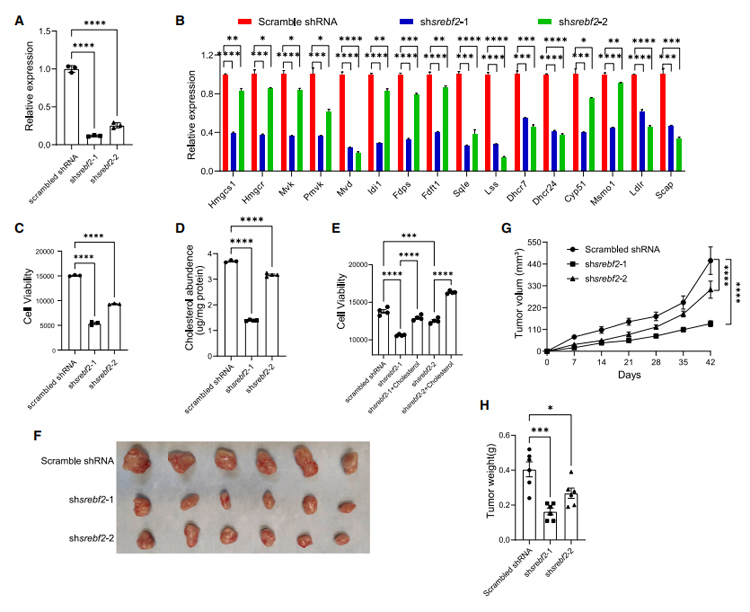
图7
02、编者点评
综上所述,研究者利用等基因胰腺类器官进行了高通量药物筛选,鉴定出了phehexiline maleate(马来酸派克西林),它可以在体内和体外抑制KRAS突变的胰腺类器官以及人原代PDAC类器官的生长并诱导凋亡。同时研究者发现胆固醇合成在KRAS突变的类器官中特异性上调,Perhexiline maleate可以降低SREBP2的表达水平,从而发挥对KRAS突变体的抑制作用。这一研究为筛选胰腺癌的靶向抑制剂提供了新的研究工具。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特类器官平台已建立多种hiPSC诱导的类器官培养平台,欢迎有需要的读者垂询!
参考文献
[1] Witkiewicz, A.K., McMillan, E.A., Balaji, U., Baek, G., Lin, W.C., Mansour,J., Mollaee, M., Wagner, K.U., Koduru, P., Yopp, A., et al. (2015). Wholeexome sequencing of pancreatic cancer defines genetic diversity andtherapeutic targets. Nat. Commun. 6, 6744.
[2] Waddell, N., Pajic, M., Patch, A.M., Chang, D.K., Kassahn, K.S., Bailey, P.,Johns, A.L., Miller, D., Nones, K., Quek, K., et al. (2015). Whole genomes redefine the mutational landscape of pancreatic cancer. Nature 518,495–501.
[3] Shankar, S., Pitchiaya, S., Malik, R., Kothari, V., Hosono, Y., Yocum, A.K.,Gundlapalli, H., White, Y., Firestone, A., Cao, X., et al. (2016). KRAS engages AGO2 to enhance cellular transformation. Cell Rep. 14, 1448–1461.
[4] Makrodouli, E., Oikonomou, E., Koc, M., Andera, L., Sasazuki, T., Shirasawa, S., and Pintzas, A. (2011). BRAF and RAS oncogenes regulate
Rho GTPase pathways to mediate migration and invasion properties in human colon cancer cells: a comparative study. Mol. Cancer 10, 118.
[5]Brown, M.S., and Goldstein, J.L. (1997). The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor. Cell 89, 331–340.
[6]Wen, Y.A., Xiong, X., Zaytseva, Y.Y., Napier, D.L., Vallee, E., Li, A.T.,Wang, C., Weiss, H.L., Evers, B.M., and Gao, T. (2018). Downregulation of SREBP inhibits tumor growth and initiation by altering cellular metabolism in colon cancer. Cell Death Dis. 9, 265.
[7]Kondo, A., Yamamoto, S., Nakaki, R., Shimamura, T., Hamakubo, T.,Sakai, J., Kodama, T., Yoshida, T., Aburatani, H., and Osawa, T. (2017).Extracellular acidic pH activates the sterol regulatory element-binding Protein 2 to promote tumor progression. Cell Rep. 18, 2228–2242.