业务咨询

![]() 发布时间:2024-06-12
发布时间:2024-06-12
![]() 环特生物
环特生物
![]() 浏览次数:4913
浏览次数:4913
编者按
人体血脑屏障(hBBB)是一种高度特化的结构,调节通过血液和中枢神经系统(CNS)之间的通道。尽管血脑屏障具有重要的生理作用,但目前还没有可靠的体外模型可以模拟血脑屏障的发育和功能。
今天,我们分享2024年5月由美国辛辛那提儿童医院医学中心研究团队发表在《Cell Stem Cell》(IF:23.9)的最新研究——Modeling blood-brain barrier formation and cerebral cavernous malformations in human PSC-derived organoids,该研究利用人类多能干细胞来源的脑和血管类器官构建了BBB组装体(assembloids),模拟了BBB的关键特性,并揭示了神经-血管间的相互作用。研究团队发现,通过比较患者来源的BBB组装体能够模拟体内CCMs的表型,包括血管异常和BBB破坏,从而揭示了CCM的潜在作用机制。
文章题目
Modeling blood-brain barrier formation and cerebral cavernous malformations in human PSC-derived organoids
杂志:《Cell Stem Cell》(IF=23.9)
发表时间:2024年5月15日
作者:Lan Dao, Zhen You, L Frank Huang, Ziyuan Guo等
单位:美国辛辛那提儿童医院医学中心等
01、研究亮点
• 利用人类多能干细胞来源的大脑和血管类器官构建了hBBB类器官模型,血脑屏障(BBB)组合体与人类BBB的主要特征相似,包括分子、细胞、转录组和功能特征;
• 揭示了神经-血管间的相互作用在血脑屏障形成中的关键作用;
• 患者来源的血脑屏障(BBB)组合体可有效模拟人类海绵状血管瘤表型;
• 血脑屏障(BBB)组合体揭示了CCM中SMC的丢失和神经血管相互作用的中断等相关分子和细胞的变化。
02、研究成果
在中枢神经系统(CNS)发育过程中,随着中胚层来源的血管母细胞侵入神经上皮区域,从而形成血管网络。在这个新生网络内,内皮细胞(ECs)会经历一个逐步的重塑过程,该过程涉及内皮细胞间紧密连接的生成及表达特化的转运蛋白和酶。期间,募集周细胞和星形胶质细胞(Asts)的招募也同样重要,为内皮细胞提供指导信号,使其获得血脑屏障(BBB)EC特异性。由于血管化和BBB成熟对CNS功能至关重要,因此该过程的任何中断或脑血管和BBB功能的任何破坏都可能导致神经系统疾病,包括脑海绵状血管瘤(CCMs)。
脑海绵状血管瘤(CCMs)是一种常见的遗传性脑血管疾病,会导致儿童、青少年和年轻人中风和神经缺陷,且缺乏有效的治疗方法。目前为止,已确定了与家族性CCMs相关的三个基因位点——KRIT1(即CCM1)、CCM2 和 PDCD10(程序性细胞死亡10,即CCM3),它们都与一般人群中CCMs发病风险增加有关。尽管脑内皮细胞中有条件地敲除CCM基因的小鼠模型可以重现病变表型,并揭示CCM基因功能丧失(LOF)与病变负担之间的相关性,但它们在模拟人类血脑屏障(BBB)的独特生理学方面存在显著的不足。具体而言,人类血脑屏障(BBB)的分子特征和功能特性与啮齿类动物模型有很大不同,且与小鼠相比,通常被认为具有更高的药物渗透性。人类血脑屏障(BBB)与动物模型在药物渗透性方面的显著差异,可能是与非CNS药物相比,临床前 CNS 药物临床试验失败率更高的原因,并强调了在推进转化研究中,对人类血脑屏障(BBB)模型的迫切需要。
基于人类诱导多能干细胞(iPSC)的脑内皮样细胞模型,可用于研究分子通透性和遗传干扰引起的屏障功能障碍。这些模型采用二维半(2.5D)方法,利用Transwell小室(插入物)、水凝胶或微流控设备来组装神经血管界面。然而,由于发育相关的分化轨迹差异、缺乏明确的脑内皮细胞特性,甚至不必要的上皮命运的获得,这些模型不太适合模拟完全形成的人类血脑屏障(BBB)。鉴于人类神经血管发育发生在三维(3D)空间中,开发出准确、真实的3D人类血脑屏障(BBB)模型来代表这一复杂的系统,可能会成为CNS药物开发的变革性工具。
人类多能干细胞(hPSC)来源的脑类器官展示了神经上皮结构的自我组织和复杂的神经元网络,但缺乏支持中胚层衍生物(如血管和BBB)发育的能力。相反,通过中胚层诱导和随后的血管诱导分化为内皮细胞(ECs)、周细胞和平滑肌细胞(SMCs),可以从hPSCs衍生出最先进的血管类器官。然而,目前尚无体外系统能够阐述原始内皮细胞如何特化为BBB特异性内皮细胞,或模拟原始毛细血管网与神经上皮组织之间的相互作用,以协调人类神经血管发育。在最近的相关工作中,Sun等人生成了分别针对血管和大脑的胚体培养物,当将它们结合在基质胶滴中时,观察到培养物之间的融合。然而,这些培养物并没有发育出血脑屏障(BBB)的主要特征,如紧密连接复合体的组装、具有突起的周细胞和包围内皮的星形胶质细胞(Asts)的足突、内皮细胞获得BBB特异性,以及低渗透性的功能完整性。因此,一个真实的体外3D人类血脑屏障(BBB)仍然是缺乏。
研究过程中,研究团队利用人类多能干细胞来源的脑和血管类器官构建了人体血脑屏障(hBBB)组装体,并发现这些类器官可以模拟人类血脑屏障(BBB)的特征,表现为特异性的紧密连接形成、BBB特异性转运蛋白的表达。此外,研究人员还观察到内皮细胞窗孔减少、周细胞突起和星形胶质细胞足突、特征性转录程序,及表明具有低渗透性的跨内皮电阻增加等。研究人员还从携带CCM1基因功能丧失(LOF)突变的患者中生成了iPSCs。
当从这些脑海绵状血管瘤(CCMs)的诱导多能干细胞(iPSCs)中衍生出血脑屏障(BBB)类器官时,观察到扩大的内皮通道的聚集,类似于体内海绵状血管瘤表型。单细胞转录组分析揭示了与CCM相关的血管生成、受损的神经血管相互作用及壁细胞发育轨迹的改变,这表明脑海绵状血管瘤(CCMs)的潜在分子和细胞病理。
最后,研究人员将患者来源的BBB类器官与从神经外科手术中切除的原始海绵状血管瘤组织进行了比较,对促进人类血脑屏障(BBB)研究、开发针对脑海绵状血管瘤及其他脑血管疾病的新疗法有着积极的作用。
03、研究成果
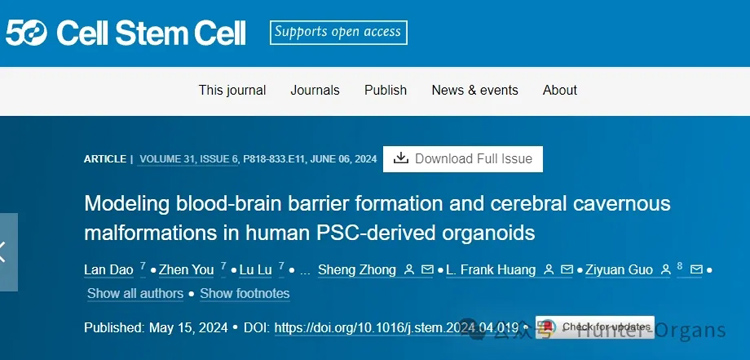
1. 人类多能干细胞(hPSC)来源的脑和血管类器官的结合
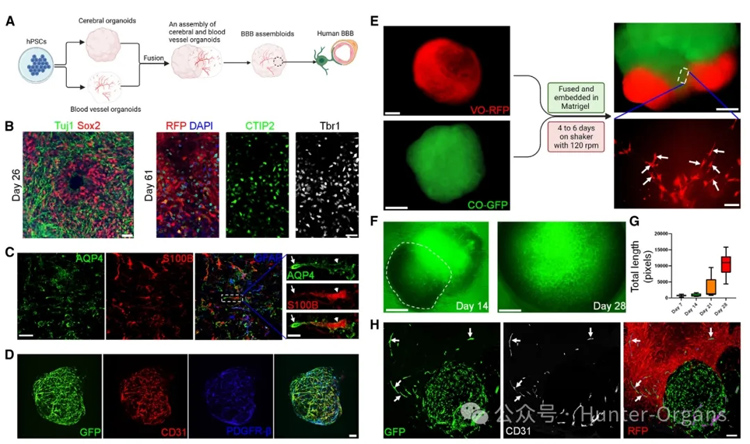
图1
中枢神经系统(CNS)的发育涉及血管的生长,这些血管有助于血脑屏障(BBB)的形成。研究人员采用了一种创新的研究思路,利用hPSCs分别诱导分化成脑类器官和血管类器官,通过特定的培养条件将两种类器官组装成三维BBB组装体,在体外模拟神经-血管发育过程(图1A),并研究其与CCMs的相互作用,为研究BBB的生理和病理提供了新的模型。
研究人员采用hPSCs,如H9胚胎干细胞(ESCs),在Matrigel涂层的培养板上培养,并使用特定的培养基诱导它们形成脑类器官。通过特定的诱导方案,包括使用Y-27632等小分子来促进神经诱导,形成胚胎体(EBs)。与脑类器官类似,血管类器官也是通过hPSCs的特定诱导分化而来。研究人员使用GFP标记的hPSCs,通过特定的培养条件和因子,如VEGF-A和Forskolin,来促进血管谱系的分化。
研究结果显示,CCM患者来源的BBB assembloids能够模拟体内CCMs的表型,包括扩大的内皮通道的聚集和BBB的破坏,如图1所示,展示了脑血管类器官与脑类器官组装后形成的复杂血管网络。
2. 模拟血脑屏障(BBB)生物学关键特性的组装体模型
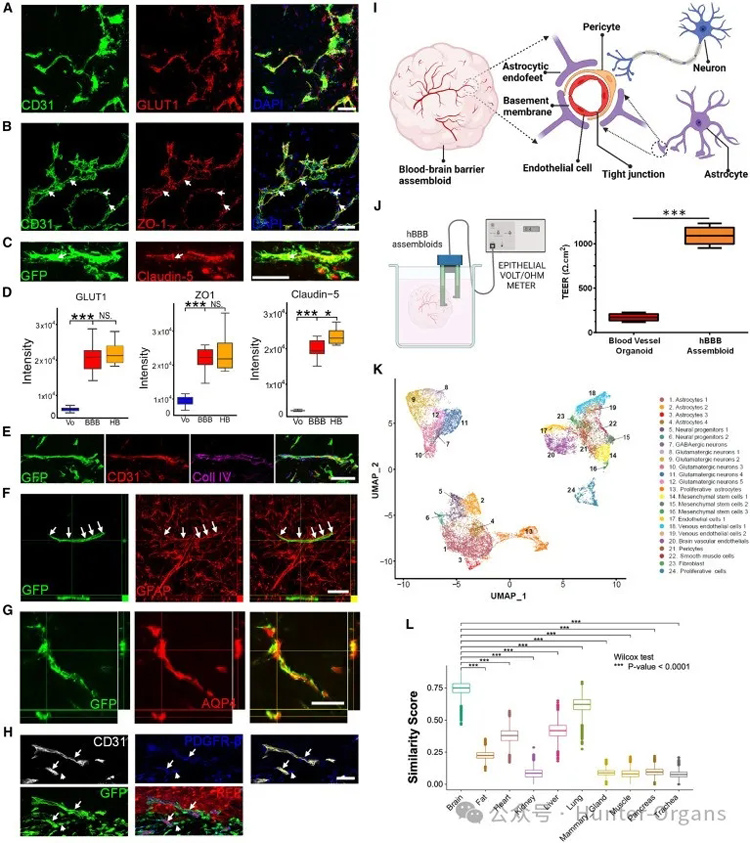
图2
大脑微血管内皮细胞(BMECs)具有与其他内皮细胞群不同的特征,从而使其具有独特的血脑屏障(BBB)功能。
为了验证神经-血管共同发育过程中血脑屏障(BBB)的特异性,在脑类器官和血管类器官成熟后,研究人员将它们在Matrigel中共同培养。通过这种共培养,脑类器官和血管类器官能够相互影响,形成类似BBB的结构和功能。
研究人员还通过一系列验证实验,包括检测紧密连接蛋白的表达、转录组分析、以及跨内皮细胞电阻(TEER)的测量等,证实了BBB组装体具有与体内血脑屏障(BBB)相似的功能。如图2所示,揭示了BBB assembloids中BBB特异性标志物的表达,为理解CCMs的病理机制提供了重要线索。
3. Wnt信号驱动内皮细胞获得血脑屏障(BBB)特性
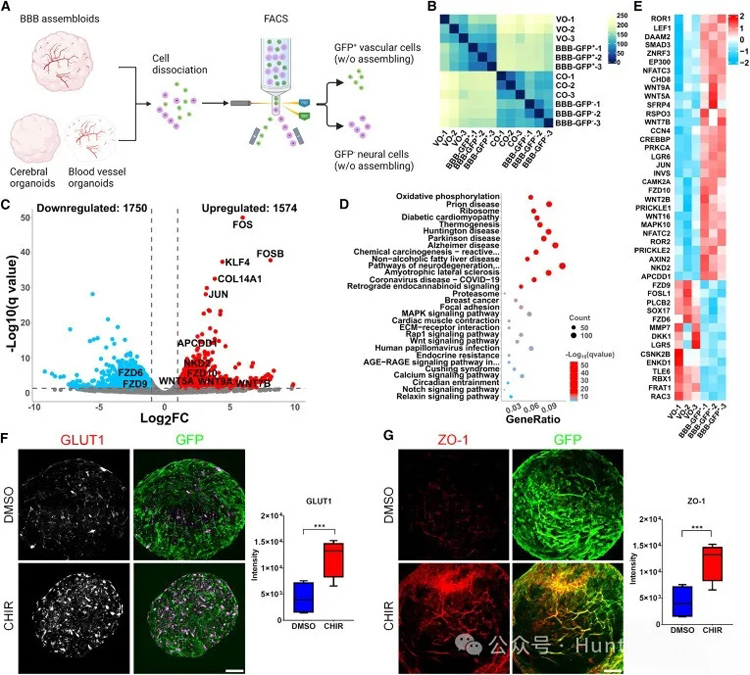
图3
为了确定大脑微血管内皮细胞特化的信号通路,研究人员使用荧光激活细胞分选法(FACS)从第30天的BBB组装体中分离出GFP阳性的血管细胞,然后使用RNA测序(RNA-seq),将其转录组与在BBB成熟培养基中培养的非组装血管类器官转录组进行比较。
研究人员发现组装体中的血管细胞,包括Wnt和Notch在内的多个信号通路发生了显著改变(图3D)。基因表达热图显示,Wnt信号通路中的40多个基因发生了显著变化,包括Wnt配体(WNT5A、WNT2B、WNT16、WNT7B和WNT9A)、轴抑制蛋白2(AXIN2)等,其中大部分基因表达上调(图3E),这表明Wnt信号通路对BBB中的BMECs的鉴定具有重要作用。
与DMSO处理的血管类器官相比,GLUT1和ZO-1的表达显著增强(图3F和3G);与BBB成熟培养基中培养的血管器官相比,BBB组合体中LEF-1表达的显著上调,证实了Wnt信号通路的激活(图S3B);与DMSO处理的血管类器官相比, CHIR处理的血管器官LEF-1表达明显升高(图S3C)。这些发现表明,仅获得Wnt信号就可以使内皮获得BBB特性,如GLUT和紧密连接蛋白的表达。
为了深入了解BBB组装体的细胞组成和分子机制,研究人员在采用单细胞RNA测序(scRNA-seq)之外,还采用了空间转录组学等技术来分析组装体中的细胞类型和基因表达模式,揭示了与CCM相关的血管生成、受损的神经血管相互作用及壁细胞发育轨迹的改变,这表明脑海绵状血管瘤(CCMs)的潜在分子和细胞病理。
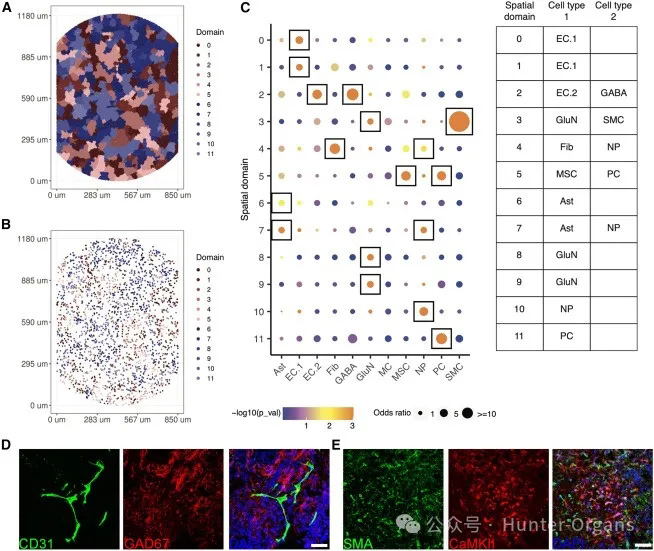
图4
4. 利用iPSCs来源的BBB组装体模拟CCM
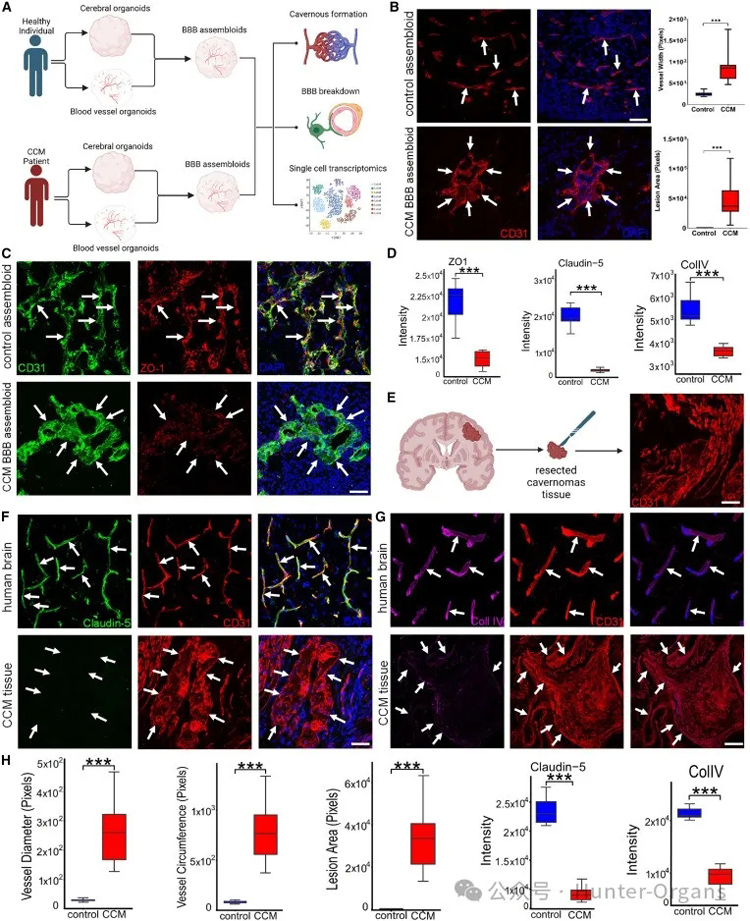
图5
为了验证BBB组装体能否用来模拟脑血管缺陷,特别是脑海绵状血管瘤(CCM)。研究人员从脑海绵状血管瘤(CCMs)的诱导多能干细胞(iPSCs)中衍生出血脑屏障(BBB)类器官,并观察到扩大的内皮通道的聚集,类似于体内海绵状血管瘤表型,还观察到紧密连接蛋白和基底膜蛋白的表达显著降低(图5C和5D),这表明BBB的破坏与动物模型中的情况类似。
通过将患者来源的BBB类器官与从神经外科手术中获取的原发性海绵状血管瘤组织进行比较(图 5E;表 S5),研究人员发现其与海绵状血管瘤表型相似,具有独特的内皮细胞(EC)细胞群(图 5E),且与患者的BBB组装体相同(图 5B),并伴有紧密连接蛋白表达的显著降低、基底膜解体(图5F-5H)。
综上所述,这些实验证实了从患者来源的iPSC衍生的BBB组装体是一个宝贵的体外模型,能够忠实地重现CCM的形态表型,从而在人类遗传学和细胞生物学背景下,对 CCM的潜在病理进行全面研究。研究人员也通过单细胞转录组学方法,以细胞特异性揭示CCM相关分子变化(图6)。
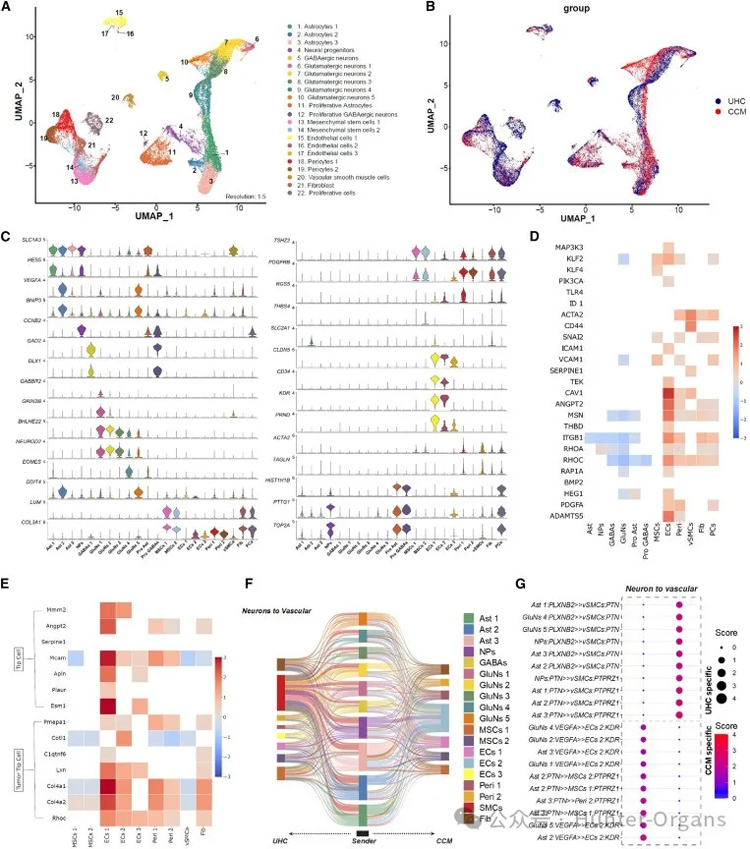
图6
5. 血管平滑肌细胞在CCMs中的发育损失
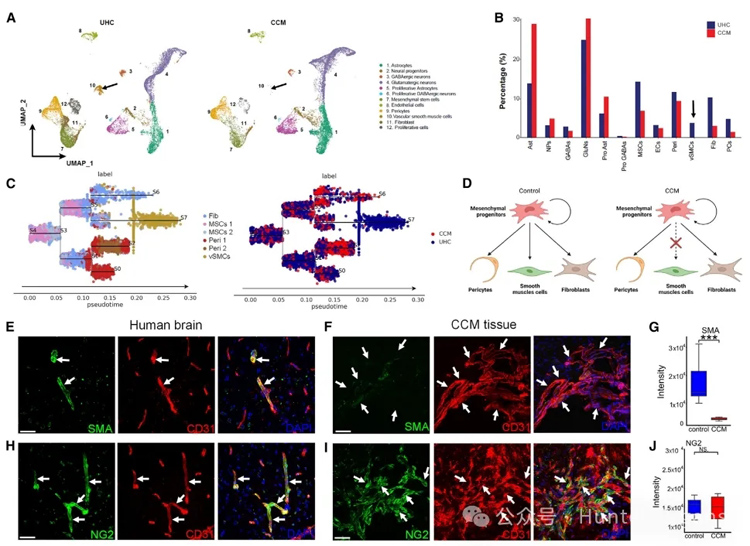
图7
周细胞、血管平滑肌细胞(VSMCs)等在血管(包括脑部血管)的发育中发挥着关键作用。研究人员通过将CCM患者来源的hPSCs衍生的BBB assembloids与健康对照组进行比较,发现了与CCMs相关的分子和细胞变化,如血管平滑肌细胞(SMCs)的丢失和神经血管相互作用的破坏。
这种神经-血管相互作用的改变可能是由于CCM中血管平滑肌细胞的发育缺失所导致的。实验数据表明,CCM中存在重要的周细胞发育缺陷,这可能导致CCM病理发生,从而造成神经-血管相互作用的相应改变。因此,CCM患者衍生的BBB组装体,为深入探究CCM发育过程中平滑肌细胞耗竭的发生机制基础提供了一个重要平台。
03、编者点评
总而言之,该研究利用人类多能干细胞生成人类血脑屏(BBB)类器官和血管类器官,类器官成熟后经共同培养形成BBB组装体,并利用患者来源类组装体探究其在海绵状血管瘤的致病机制。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型及人诱导多能干细胞及多种癌种的类器官培养平台,欢迎有需要的读者垂询!
参考文献
[1] Saili, K.S., Zurlinden, T.J., Schwab, A.J., Silvin, A., Baker, N.C., Hunter, E.S., 3rd, Ginhoux, F., and Knudsen, T.B. (2017). Blood-brain barrier development: Systems modeling and predictive toxicology. Birth Defects Res. 109, 1680–1710.
[2] Hajal, C., Le Roi, B., Kamm, R.D., and Maoz, B.M. (2021). Biology and Models of the Blood-Brain Barrier. Annu. Rev. Biomed. Eng. 23, 359–384.
[3] Langen, U.H., Ayloo, S., and Gu, C. (2019). Development and Cell Biology of the Blood-Brain Barrier. Annu. Rev. Cell Dev. Biol. 35, 591–613.
[4] Zhao, Z., Nelson, A.R., Betsholtz, C., and Zlokovic, B.V. (2015). Establishment and Dysfunction of the Blood-Brain Barrier. Cell 163, 1064–1078.
[5] Leblanc, G.G., Golanov, E., Awad, I.A., and Young, W.L.; Biology of Vascular Malformations of the Brain NINDS Workshop Collaborators (2009). Biology of vascular malformations of the brain. Stroke 40, e694– e702.
[6] Akers, A., Al-Shahi Salman, R., A Awad, I., Dahlem, K., Flemming, K., Hart, B., Kim, H., Jusue-Torres, I., Kondziolka, D., Lee, C., et al. (2017). Synopsis of Guidelines for the Clinical Management of Cerebral Cavernous Malformations: Consensus Recommendations Based on Systematic Literature Review by the Angioma Alliance Scientific Advisory Board Clinical Experts Panel. Neurosurgery 80, 665–680.
[7] Batra, S., Lin, D., Recinos, P.F., Zhang, J., and Rigamonti, D. (2009). Cavernous malformations: natural history, diagnosis and treatment. Nat. Rev. Neurol. 5, 659–670. https://doi.org/10.1038/nrneurol.2009.177.
[8] Haasdijk, R.A., Cheng, C., Maat-Kievit, A.J., and Duckers, H.J. (2012). Cerebral cavernous malformations: from molecular pathogenesis to genetic counselling and clinical management. Eur. J. Hum. Genet. 20, 134–140.
[9] Draheim, K.M., Fisher, O.S., Boggon, T.J., and Calderwood, D.A. (2014). Cerebral cavernous malformation proteins at a glance. J. Cell Sci. 127, 701–707.
[10] Snellings, D.A., Hong, C.C., Ren, A.A., Lopez-Ramirez, M.A., Girard, R., Srinath, A., Marchuk, D.A., Ginsberg, M.H., Awad, I.A., and Kahn, M.L. (2021). Cerebral Cavernous Malformation: From Mechanism to Therapy. Circ. Res. 129, 195–215.