业务咨询

![]() 发布时间:2025-07-05
发布时间:2025-07-05
![]() 环特生物
环特生物
![]() 浏览次数:1559
浏览次数:1559

编者按
急性心肌梗死(AMI)是一种危及生命的心血管急症,以其高发病率、高死亡率成为常见的急危重症疾病。与哺乳动物不同,斑马鱼通过心肌细胞(CMs)的增殖来实现心脏的完全再生。
今天,我们分享2025年2月由德国乌尔姆大学、博罗尼亚大学等研究团队联合在《Nature Communications》杂志上发表的最新研究,该研究表明克服复制压力的能力是增强斑马鱼心脏再生能力的关键因素,并揭示了BMP信号在促进无压力DNA复制中的作用。
研究发现,再生的心肌细胞经历DNA复制压力,是哺乳动物衰老过程中组织再生能力下降的原因之一。通过抑制ATM和ATR激酶,表明DNA损伤应答信号对斑马鱼心脏再生至关重要。利用转基因和突变体操纵骨形态发生蛋白(bone morphogenetic protein,BMP)-Smad信号表明,BMP信号可缓解心肌细胞的复制压力,也能使新生小鼠的心肌细胞、人类成纤维细胞、人造血干细胞(HSCs)及祖细胞(HSPCs)免受复制压力的影响。DNA纤维测定技术分析表明,BMP信号可以在复制压力导致的停滞后重新启动复制叉。
文章题目
BMP signaling promotes zebrafish heart regeneration via alleviation of replication stress
杂志:Nature Communications(IF=16.6)
发表时间:2025年2月17日
作者:Mohankrishna Dalvoy Vasudevarao, Hartmut Geiger &Gilbert Weidinger et al.
单位:德国乌尔姆大学、博罗尼亚大学等
DOI: 10.1038/s41467-025-56993-6
01、研究亮点
• 首次证明斑马鱼心脏再生过程中,增殖的心肌细胞(CMs)会经历显著的DNA复制压力,这被认为是哺乳动物衰老过程中组织再生能力下降的关键限制因素;
• 发现骨形态发生蛋白(BMP)信号通路,特别是BMP7a配体通过Smad依赖性途径,在缓解心肌细胞复制压力中的核心作用。BMP信号通过促进停滞的复制叉重新启动(fork re-start)来实现这一功能;
• 证明DNA损伤响应通路对斑马鱼心脏再生至关重要,抑制ATM及ATR激酶会阻断心肌细胞增殖和再生;
• 研究发现,斑马鱼心脏再生并非避免了复制压力,而是具备了BMP信号等强大的机制来克服这种压力,为理解再生能力差异和开发抗衰老、促再生策略提供了新视角。
02、研究结果
1. 斑马鱼心脏再生过程中心肌细胞变为γH2a.x阳性
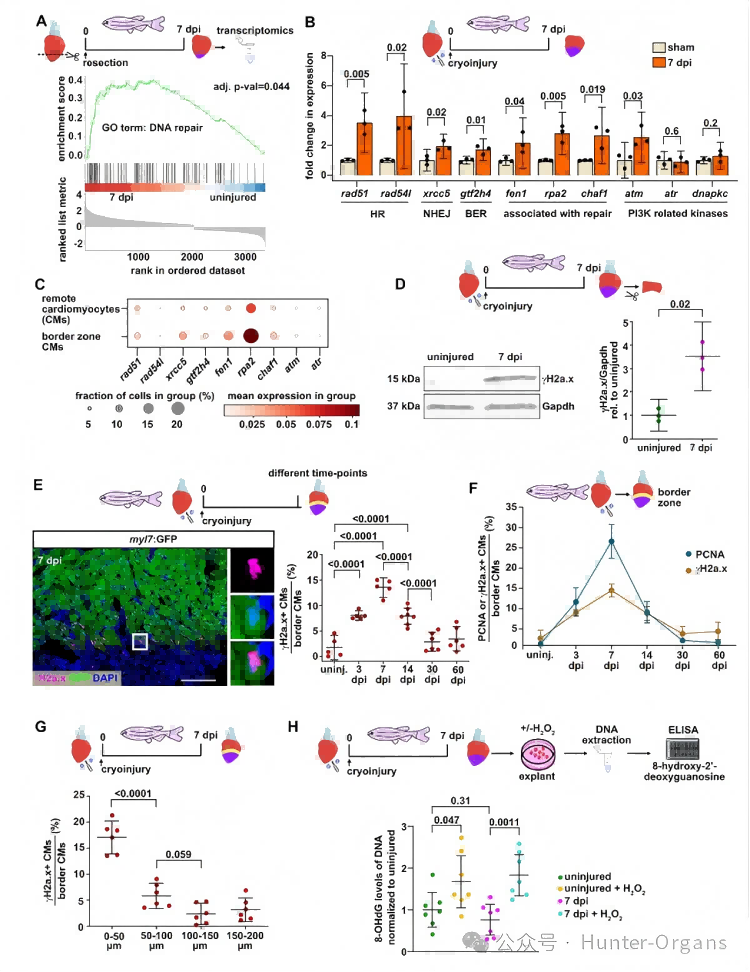
为了探究心脏再生机制,研究人员分析了斑马鱼心脏转录组,注意到与DNA修复相关的基因特征在损伤后7天(dpi)富集,这代表了CM增殖的高峰期。qRT-PCR显示,在冷冻损伤的心脏中,多种DNA损伤反应通路的基因在7dpi时上调。位于伤口边缘的心肌细胞(CMs)是心脏再生的关键,用于分化、增殖以替换受损的心肌。利用单细胞测序发现,一些上调的DNA修复相关基因在7dpi时,其伤口边缘区的心肌细胞(CMs)表达比远端的更强。
通过蛋白质印迹检测到,7dpi时心脏中的DNA损伤标志物——γH2a.x水平升高;免疫荧光显示,在7dpi时,伤口边缘的一部分心肌细胞呈γH2a.x阳性,且与细胞周期的进展密切相关。γH2a.x阳性心肌细胞的数量随伤口距离而减少。经心尖切除术(AR)的再生新生心脏组织(AR-Neo-EVs)中也观察到了γH2a.x阳性心肌细胞。这些数据表明,再生心脏中的心肌细胞经历了DNA损伤,但与损伤类型无关,且不太可能直接由损伤本身引起。
随后,研究人员利用DNA氧化损伤的重要标志物——8-羟基脱氧鸟苷(8-OHdG)进行了酶联免疫吸附试验 (ELISA) 。实验结果显示,心脏外植体的过氧化物处理诱导了DNA氧化,但与未受伤的心脏相比,仅冷冻损伤并未增加8-OHdG水平。这表明,斑马鱼的DNA氧化损伤不太可能是心肌细胞中γH2a.x阳性(即DNA损伤反应)的原因。
2. 心肌细胞在再生过程中经历复制压力
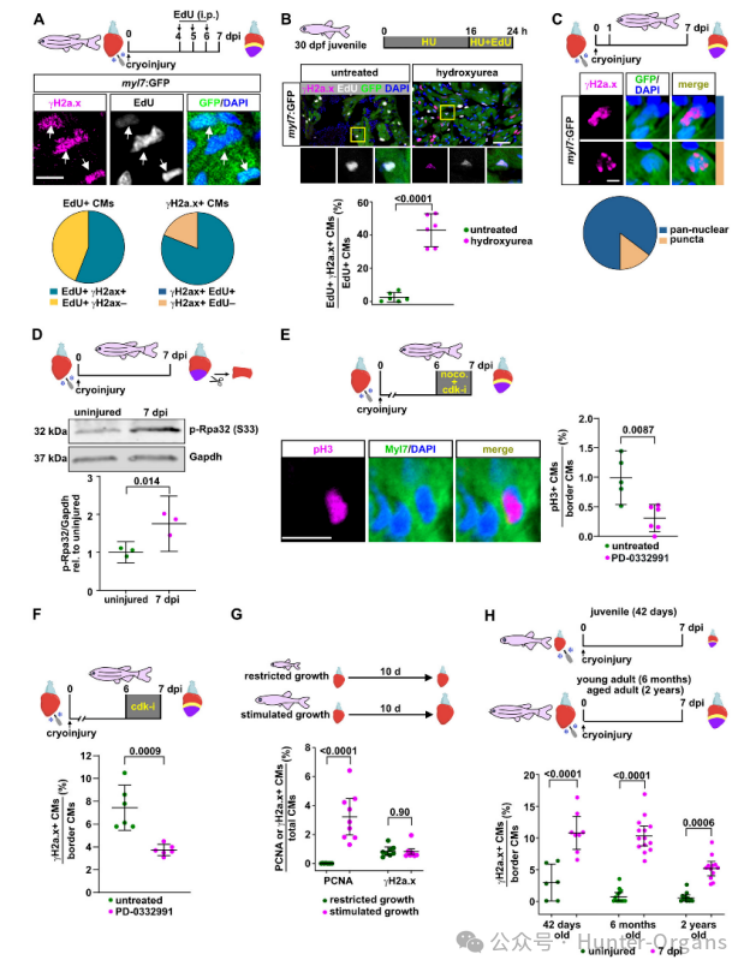
γH2a.x积累的时间和空间分布特征表明,在伤口边缘进入细胞周期的心肌细胞经历了DNA损伤。研究人员在7dpi时对γH2a.x和EdU标记进行染色后发现,γH2a.x阳性主要出现在最近或仍在分裂的心肌细胞,这表明心肌细胞变为γH2a.x阳性是因为在再生过程中其进入细胞周期时经历了复制压力。
在未受伤心脏中,只有0.62%的心肌细胞是γH2a.x阳性,而用羟基脲(HU)处理,其消耗细胞的核苷酸从而引起复制压力,诱导了γH2a.x阳性。EdU和γH2a.x的双重染色显示,在分裂中的心肌细胞,γH2a.x积累很少见(2.3%),但HU处理可显著增加其比例。同样,在冷冻损伤的心脏中,HU处理增加了γH2a.x阳性心肌细胞的比例。这些数据表明,γH2a.x通常并不标记分裂中的斑马鱼心肌细胞,而是作为复制压力的可靠指标。
γH2a.x在细胞核中的定位也指示了DNA损伤的不同类型。如,电离辐射主要导致双链断裂,从而引起再生心脏的心肌组织中出现明显的点状γH2a.x积累,而HU则引起泛核γH2a.x染色。在未受干扰的再生心脏中,84%的γH2a.x阳性心肌细胞显示泛核γH2a.x分布。磷酸化Rpa32是形成单链DNA结合蛋白RPA复合物的一部分,磷酸化Rpa32积累被认为是复制压力的特异性指标。蛋白质印迹显示,在7dpi时,心肌心室组织中p-Rpa32(S33)水平显著增加。因此,通过γH2a.x积累可以发现,伤口边缘的心肌细胞经历复制压力。
为了进一步研究再生心脏中心肌细胞增殖与γH2a.x积累之间的相关性,研究人员使用CDK4/6抑制剂PD-0332991来直接抑制细胞周期进程,结果发现,7dpi时显著减少分裂期pH3阳性心肌细胞和γH2a.x阳性心肌细胞的数量。需要注意的是,生理状态下心肌细胞的增殖不会引起γH2A.X阳性的累积,而在心脏受伤时,γH2A.X会在心肌细胞中累积。总之,这些发现表明,心肌细胞的复制压力是由再生需求诱导的特异性引起,而不是由生理性生长诱导的。
此外,通过HU处理诱导的外源性复制压力并不影响心肌细胞去分化的三个指标,即祖细胞标志物gata4调控区活性的转基因的上调、胚胎肌球蛋白(embMHC)的上调或肌节的解体,这表明心肌细胞去分化独立发生。
3. 心肌细胞复制压力可能并非由DNA损伤积累或转录碰撞引起
在幼鱼期(42天)、成年早中期(6个月)和老年期(2岁)的斑马鱼再生心脏中,并未观察到γH2a.x阳性心肌细胞比例的增加,这表明心肌细胞复制压力不太可能由存在的DNA损伤阻碍复制叉引起。而针对活性、延伸的磷酸化RNA聚合酶II的免疫染色显示,伤口边缘心肌细胞的总体转录水平低于心室其他区域,这表明心肌细胞的增殖也不大可能是由转录碰撞引起的。
4. DNA损伤信号传导对心脏再生是必需的
随后,研究人员探究了经历复制压力的心肌细胞是否会衰老或凋亡。在7dpi时,衰老标志物β-半乳糖苷酶在心外膜细胞中表达上调,而非心肌细胞中,这与先前在再生斑马鱼和新生小鼠心脏中的报道一致。用HU处理则并未诱导心肌细胞衰老,因此,经历复制压力的心肌细胞不会衰老。
在未受干扰的再生心脏中,通过检测Caspase3的积累发现,只有0.27%的伤口边缘心肌细胞凋亡,而电离辐射可以诱导了心肌细胞凋亡。这表明,尽管斑马鱼心肌细胞保留了响应DNA损伤诱导促凋亡信号的能力,但经历复制压力的斑马鱼心肌细胞能克服复制压力并继续增殖。
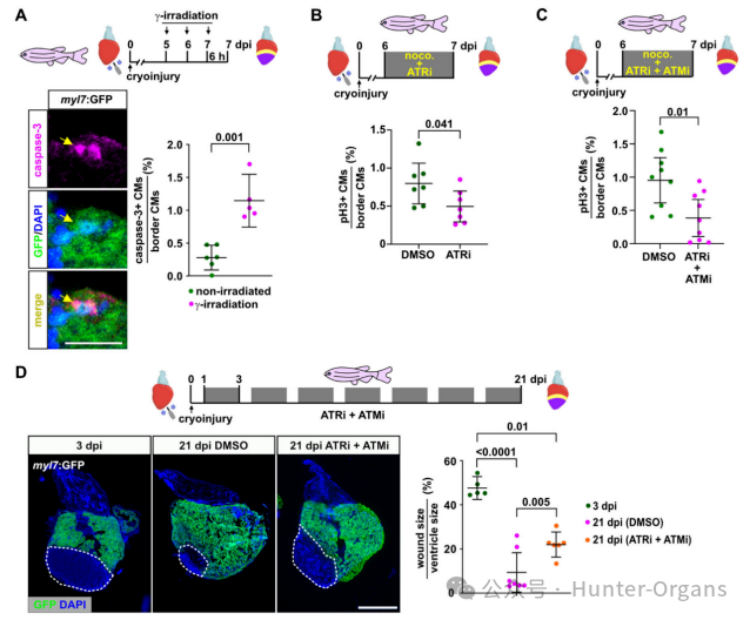
基于此,感知复制压力的DNA损伤通路可能对心脏再生是必需的。因此,研究人员又利用ATM和ATR激酶的抑制剂来分别介导对DNA损伤和复制压力的细胞反应,并观察其在斑马鱼中是否有效。研究发现,ATM抑制剂KU55933和ATR抑制剂VE821是无毒的,其不影响胚胎发育,但用ATR抑制剂处理的胚胎在单独使用小剂量的HU中出现坏死,而ATM抑制剂则加剧了低剂量电离辐射的影响,表明这些抑制剂阻断了斑马鱼细胞响应复制压力,以及其他形式的DNA损伤激活修复通路的能力。
研究人员还发现用ATR抑制剂VE821处理斑马鱼24小时后,在7dpi时减少再生心脏中的心肌细胞有丝分裂。已知ATM和ATR激酶通路可以交叉作用,以促进复制压力反应,联合使用ATM和ATR抑制剂比单独使用ATR抑制剂,更显著地抑制了心肌细胞的有丝分裂,且两种抑制剂联合治疗也损害了心脏的再生修复。总之,这表明,由ATR介导,并有ATM参与的DNA损伤修复通路的激活,对再生性心肌细胞增殖和心脏再生至关重要。
5. BMP信号传导缓解心肌细胞复制压力
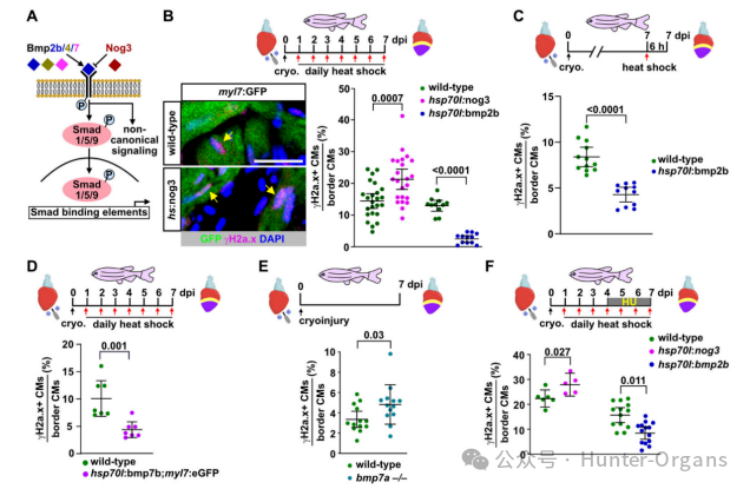
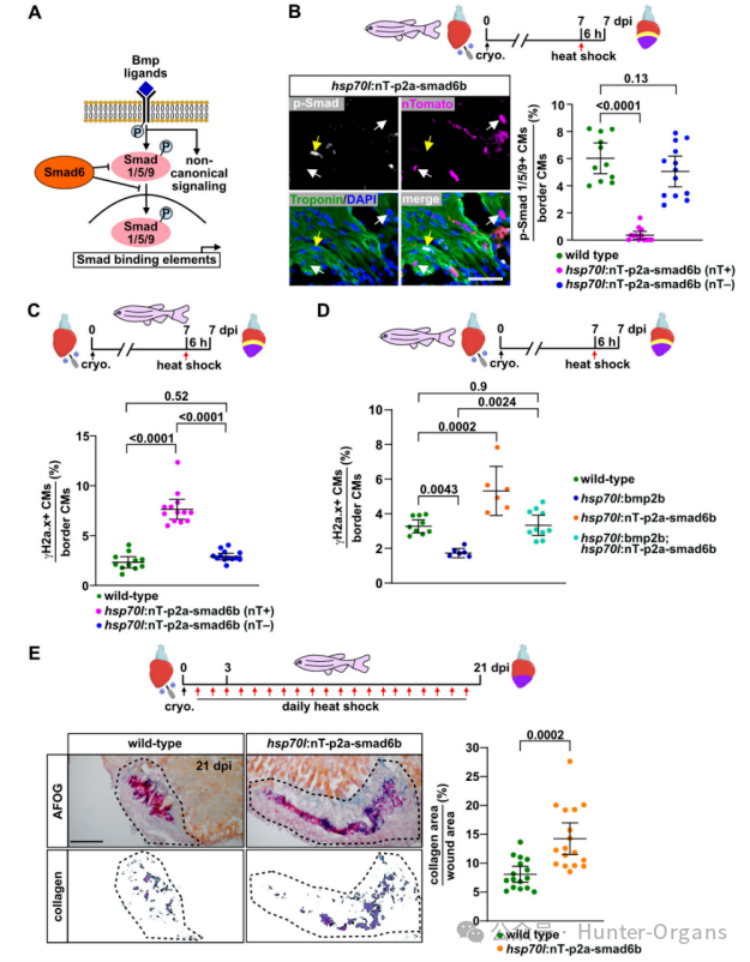
我们先前已证明在斑马鱼心脏再生过程中,BMP信号在伤口边缘的心肌细胞中CMs中被激活,但在生理性生长条件下则不会被激活,且它对再生性心肌细胞的增殖至关重要。因此,研究人员探究了BMP信号是否调节斑马鱼心肌细胞的复制压力,结果显示,表达nog3的斑马鱼在7dpi时显示出更高比例的γH2a.x阳性心肌细胞,而过表达BMP配体bmp2b则有效地减少了γH2a.x阳性心肌细胞的数量。在7dpi时,单次诱导bmp2b过表达可以在6小时内显著减少γH2a.x阳性心肌细胞的数量,这表明BMP信号可以直接作用于经历复制压力的增殖心肌细胞。
过表达bmp7b或bmp4也可以减少γH2a.x阳性心肌细胞的比例。在7dpi时,γH2a.x阳性心肌细胞的比例增加,p-Smad1/5/9水平降低,而突变体和野生型心脏之间则没有形态学差异。因此,在再生过程中,内源性BMP信号缓解心肌细胞复制压力是必需的,且Bmp7a作为不可替代的配体也在其中发挥作用。有趣的是,在HU处理的斑马鱼中,nog3过表达进一步增加了γH2a.x阳性心肌细胞的比例,而bmp2b过表达则显著降低了这一比例。这些结果表明,BMP信号不仅可以缓解内源性复制压力,也能缓解外源性复制压力。
6. BMP通过Smad发挥作用以抑制复制压力
BMP配体可以激活Smad依赖性和非依赖性信号通路。为了探究BMP是否通过Smad缓解斑马鱼心脏的复制压力,研究人员创建了转基因品系hsp70l:nT-p2a-smad6bulm16Tg来比较nT+和nT-的心肌细胞。在7dpi热休克后6小时内,nT+心肌细胞通过磷酸化Smad1/5/9核积累显示出Smad信号传导被抑制,nT+心肌细胞比野生型或nT-心肌细胞呈γH2a.x阳性的频率高出3倍。因此,BMP/Smad信号传导在心肌细胞中可以自主缓解复制压力。
为了验证过表达的BMP配体是否仅通过Smad通路发挥作用,研究人员分析后发现,bmp2b过表达增加了p-Smad1/5/9+心肌细胞的比例,而smad6b降低了该比例,但在双转基因鱼中,p-Smad1/5/9+心肌细胞的比例与野生型中观察到的一致。仅表达bmp2b的斑马鱼显示γH2a.x+心肌细胞数量显著减少,但smad6b的过表达可以逆转bmp2b过表达对γH2a.x的影响。总之,这些数据表明BMP信号直接在心肌细胞中,通过Smad发挥作用,以缓解复制压力。
为了探究抑制BMP/Smad信号传导对形态学心脏再生和瘢痕形成的长期影响,研究人员对冷冻损伤的转基因斑马鱼及其野生型斑马鱼每日热休克,连续处理21天,评估伤口大小和胶原沉积。在3dpi时伤口大小没有差异,但冷冻损伤心脏在21 dpi时显示出更大的伤口,且伤口含有许多胶原。这表明,BMP/Smad信号传导对心脏再生和瘢痕消退是必需的。
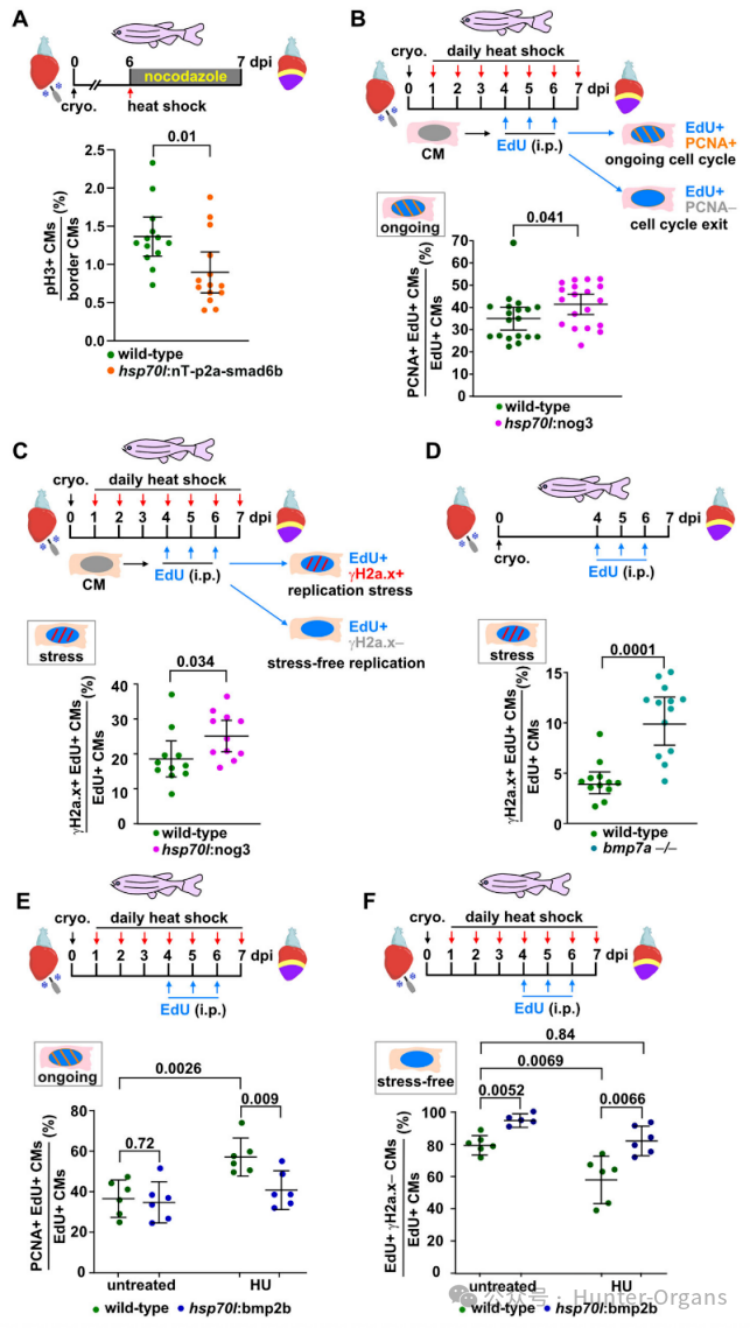
7. BMP信号传导促进无压力复制和有丝分裂进程
在冷冻损伤的斑马鱼中,单次诱导smad6b表达在6小时内减少了pH3阳性有丝分裂心肌细胞的比例。通过重复EdU注射标记受伤的野生型和转基因斑马鱼,观察其增殖的心肌细胞3天,并在7dpi时染色,发现单个心肌细胞不会经历多轮细胞分裂,在4、5或6dpi时增殖的少数心肌细胞在7dpi时仍在增殖,此时许多心肌细胞已不再增殖。在热休克的野生型斑马鱼中,在7dpi时只有约35%的EdU+心肌细胞是PCNA+的,通过过表达nog3抑制BMP信号传导增加了EdU+PCNA+心肌细胞的比例,smad6b过表达增加了PCNA+ CMs的比例,但减少了CM有丝分裂,这表明smad6b诱导了心肌细胞周期延迟,导致正在进行细胞周期的心肌细胞增加。
随后,研究人员又重复EdU注射标记增殖的心肌细胞,对EdU和γH2a.x进行染色,发现EdU+γH2a.x阳性心肌细胞经历复制压力,而仅EdU+的心肌细胞则无压力复制。过表达nog3会增加EdU+γH2a.x阳性心肌细胞的。总的来说,这表明,BMP信号传导特异性促进心肌细胞增殖,使心肌细胞能够克服复制压力,并进入有丝分裂。
接下来,为了探究BMP信号激活能否促进心肌细胞细胞周期进程和无压力复制,研究人员发现,在未受干扰的条件下,bmp2b过表达不会降低PCNA+ EdU+ 心肌细胞的比例,但能缓解由HU处理引起的数量增加。无论是在未受干扰条件下还是在HU诱导的复制压力下,bmp2b过表达都能增加经历“无压力”复制的EdU+ γH2a.x-心肌细胞的比例。
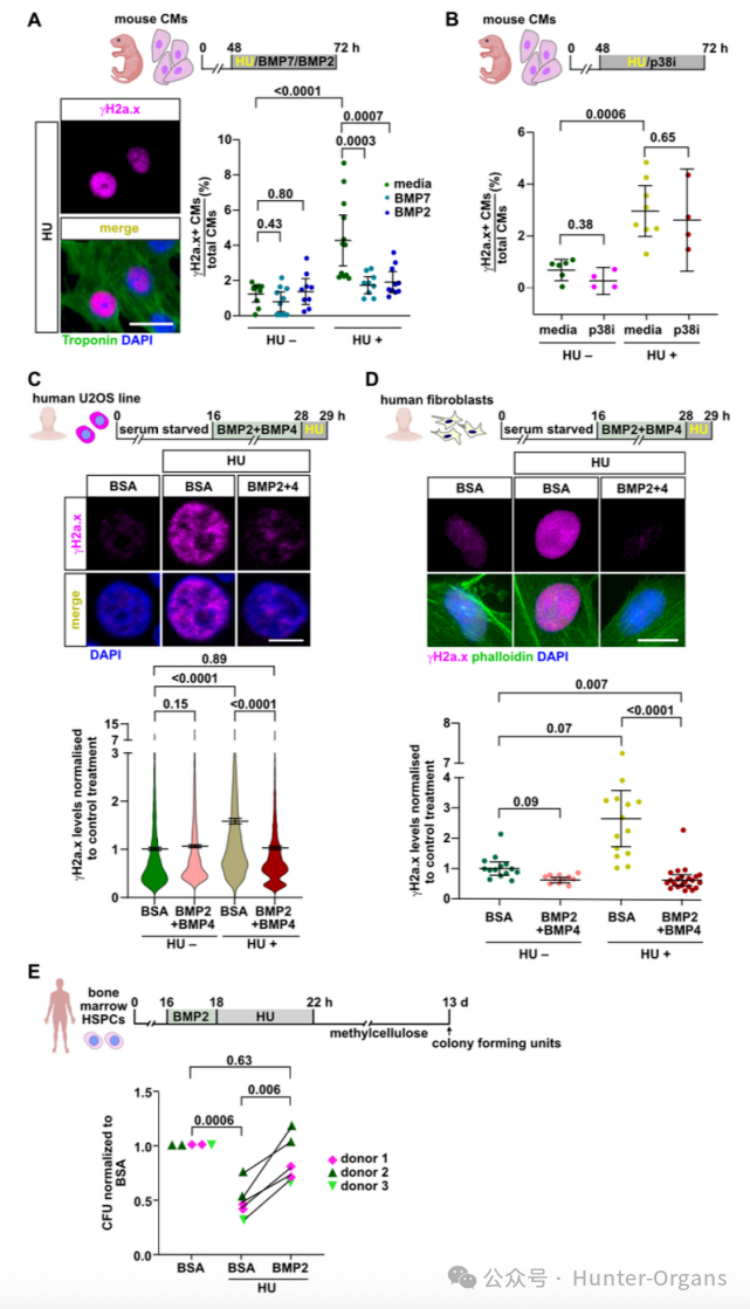
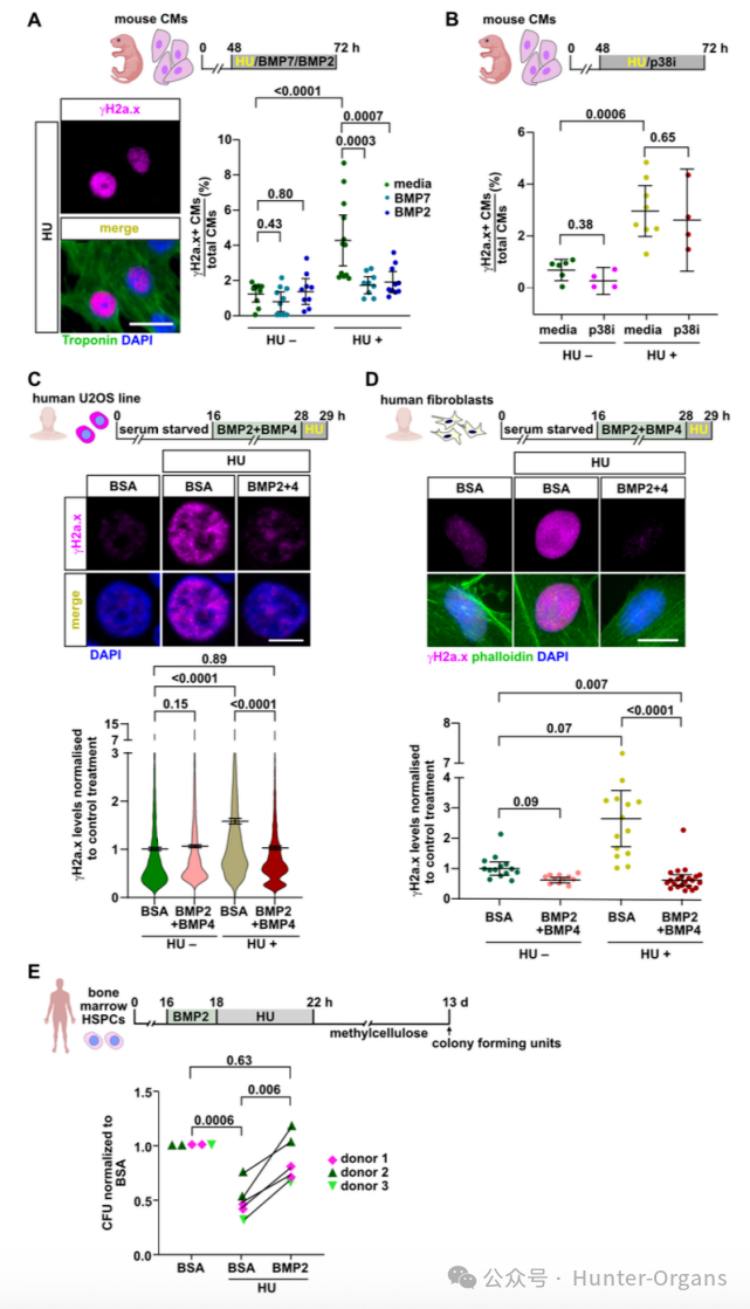
8. BMP信号在哺乳动物及人类细胞中的保守性
随后,研究人员进一步探究了BMP信号在哺乳动物及人类细胞中缓解复制压力的能力。哺乳动物实验结果表明,成纤维细胞/U2OS细胞中,BMP2+BMP4预处理可防止HU诱导的γH2a.x积累;造血干细胞/祖细胞 (HSPCs)中,BMP2预处理可完全挽救HU对原代人骨髓HSPCs集落形成能力的损伤;重组BMP2或BMP7蛋白处理可保护培养的新生小鼠心肌细胞免受HU诱导的复制压力,减少γH2a.x+细胞,且这种保护作用具有特异性。
通过DNA纤维铺展分析显示,BMP信号在人脐带血HSPCs/U2OS细胞中表现为CldU/IdU轨道长度增长, BMP2或BMP4处理能增加复制叉的进程速度;在U2OS细胞中,HU诱导复制叉停滞的模型则能通过BMP2或BMP4预处理,显著提高复制叉再启动的比例。BMP信号能增强复制动力学,少部分通过增强复制叉重新启动能力来缓解复制压力。
03、编者点评
本研究利用斑马鱼揭示了复制压力是限制组织再生,尤其是心脏再生的关键瓶颈,并发现BMP-Smad信号通路作为克服这一瓶颈的核心保守机制,为理解再生生物学和开发再生医学策略提供了重要的新见解。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!