业务咨询

![]() 发布时间:2025-09-17
发布时间:2025-09-17
![]() 环特生物
环特生物
![]() 浏览次数:0
浏览次数:0
斑马鱼,作为一种重要模式生物,具有生长周期短、繁殖能力强、胚胎透明等特点,已被广泛应用于生物学、医学及环境科学等领域。近年来,环境污染问题日益严重,环境中的风险物质对生物体的健康影响备受关注。
本研究旨在利用斑马鱼模型,评价环境中风险物质对斑马鱼胚胎的急性毒性及其对甲状腺的干扰效应,为环境风险评估和人体健康保护提供科学依据,并为预防和治疗相关疾病提供新的思路和方法。
01、斑马鱼模型的实验原理
斑马鱼在24hpf身体基本成形,在2-3dpf时,胚胎已经孵化。22hpf开始心跳,48hpf完成心血管系统发育,在2dpf时,斑马鱼心脏处于比较敏感阶段,因此比较适合用于研究心血管毒性。
3dpf的斑马鱼肝脏结构和功能发育完全,在肝细胞组成、功能、信号转导、对损伤的反应以及介导肝脏疾病的细胞过程等方面与人类肝脏相似;胚胎和成年斑马鱼的肾脏解剖结构的分子特征揭示了细胞组成和肾单元段模式与人的总体保守性;斑马鱼的视觉系统与包括人类在内的其他脊椎动物非常相似,例如其视网膜和晶状体的形态和结构,以及其在5dpf就具有视觉功能;36hpf斑马鱼胃肠道开始发育,3dpf时开始收缩,4dpf斑马鱼肠道中已经出现微生物,同时胰脏等消化器官与斑马鱼肠道同步发育,5dpf消化系统基本发挥功能。
斑马鱼体外受精和发育可以同时观察到颅面区、大脑、眼睛、心脏、肝脏、胃肠道、脊索、躯干、卵黄囊吸收、水肿、色素沉着、循环系统等大量毒理学终点,从而提供了理想的模型。参考OECD 236斑马鱼急性毒性方法,在斑马鱼受精卵开始处理,可以客观的评价样品对于各个器官的毒性情况。
与高等脊椎动物相似,斑马鱼也存在下丘脑-垂体-甲状腺轴,斑马鱼甲状腺发育的机制与人类甲状腺发育的机制相似。成年斑马鱼的甲状腺由形状和直径各异的滤泡组成,位于第一腮弓和主动脉球之间,沿着腹主动脉分布。在斑马鱼中甲状腺早期发育过程中前肠内胚层细胞会发展为组成甲状腺的细胞,在咽腔底部聚集成一块组织结构。甲状腺原基从咽腔底部分离出来,沿着前颈区域朝尾部移动。
随着甲状腺组织的增长和发育,甲状腺的最终形态逐渐确定。同时,原代细胞开始形成滤泡,并最终分化成能够产生激素的甲状腺细胞。这些细胞表达甲状腺球蛋白(tg),钠碘共转运蛋白(nis,slc5a5),甲状腺过氧化物酶(tpo)和甲状腺刺激素受体(tshr)等甲状腺分化标记物。
甲状腺滤泡的形成不仅涉及到细胞形态的变化,更重要的是细胞功能的成熟。在滤泡内部,甲状腺细胞开始合成和分泌甲状腺激素,如三碘甲状腺原氨酸(T3)和四碘甲状腺原氨酸(T4)。这些激素对于斑马鱼的生长、发育和代谢都至关重要。
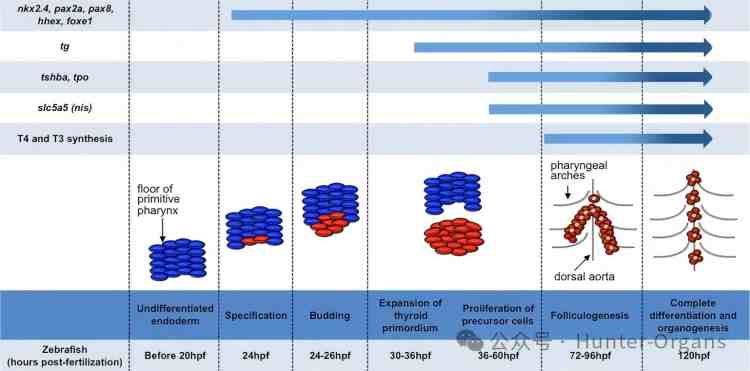
图1. 斑马鱼甲状腺发育过程

图2. 斑马鱼甲状腺与人的比较
02、斑马鱼研究与实验方法
研究内容与实验方法
1. 风险物质暴露实验(确定MNLC和LC10)
设置正常对照组、风险物质5个浓度组进行暴露,观察死亡率和毒性情况,测定MNLC和LC10。
2. 风险物质胚胎急性毒性评价
随机选取4-16细胞期野生型AB品系斑马鱼于6孔板中,每孔(实验组)均处理30尾斑马鱼,每孔容量为3mL。
①28 ℃处理至24 hpf时,每个实验组拍摄视频,分析斑马鱼自发运动;
②处理至48 hpf时,每个实验组在解剖显微镜下观察:卵凝结、体节形成异常、尾部延伸停止和无心跳,并统计发生率;
③处理至48 hpf时,每个实验组在解剖显微镜下观察并统计斑马鱼心率;
④处理至72 hpf时,每个实验组在解剖显微镜下观察并统计斑马鱼孵化率;
⑤处理至120 hpf时,每个实验组在解剖显微镜下观察并记录斑马鱼心脏、循环系统、出血及血栓、脑、下颌、眼睛、肝脏、肾、肠道、躯干/尾/脊索、肌肉/体节、身体着色、体长等反应情况,采集典型毒性器官照片并统计毒性发生率并鉴别毒性靶器官;
⑥处理至120 hpf时,每个实验组随机选取10尾斑马鱼在解剖显微镜下拍照,分析斑马鱼体长;
⑦处理至120 hpf时,每个实验组随机选取10尾斑马鱼置于行为分析仪下,分析斑马鱼总运动距离,评价样品对运动功能的影响。
3. 甲状腺的影响(甲状腺转基因斑马鱼)
利用甲状腺荧光转基因斑马鱼,通过对比分析对照组和实验组斑马鱼的甲状腺荧光强度的变化,评价风险物质对甲状腺的影响。利用统计学方法,分析风险物质浓度与甲状腺之间的相关性。
4. T3和T4影响评估
通过试剂盒检测斑马鱼整体T3和T4水平,通过对比分析对照组和实验组斑马鱼的T3和T4水平,评价风险物质对甲状腺激素的影响。利用统计学方法,分析风险物质浓度与T3和T4水平之间的相关性。
机制研究内容
1. 对甲状腺滤泡细胞的影响(全胚胎免疫组化);
2. 对相关基因表达量的影响(qRT-PCR);
3. 多组学研究(转录组学、代谢组学和蛋白组学):新通路、新机制和新的生物标志物的发现;
(备注:qRT-PCR和转录组可二选一)
4. 机制验证
4.1 基因编辑技术
基因瞬时敲降或瞬时过表达:通过5.2筛选到风险物质调控的关键基因,并确认风险物质与关键基因表达的相关性,再在斑马鱼中上调或下调关键基因的表达,确认风险物质与关键基因功能的相关性;
4.2 基因蛋白验证(如多组学选择转录组学或蛋白组学研究,则进行下述实验)
①QPCR基因验证:选择转录组得到的样品调控的关键基因,进行QPCR验证;
②蛋白验证:WB、试剂盒、免疫荧光检测验证。
结果展示
(*展示图片仅供参考,实际实验组别依据合同而定)
1. MNLC和LC10:提供“浓度-死亡率”效应曲线;
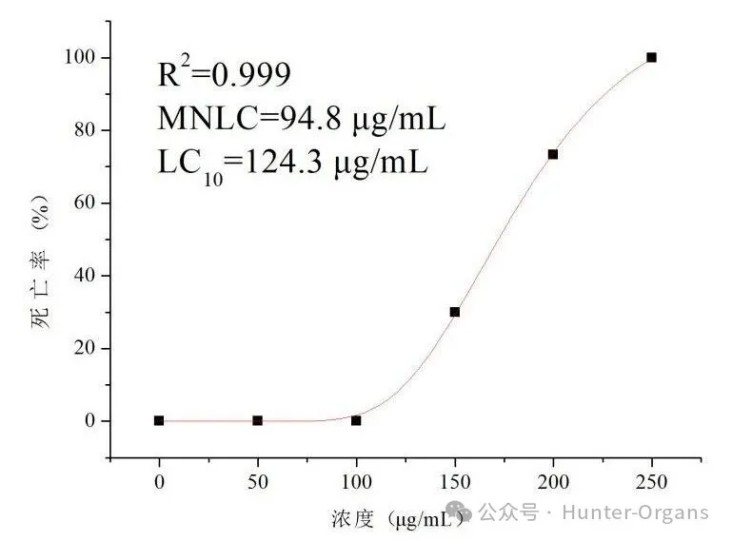
图3. 斑马鱼“浓度-死亡率”效应曲线
2. 毒性表型评价:提供表型图
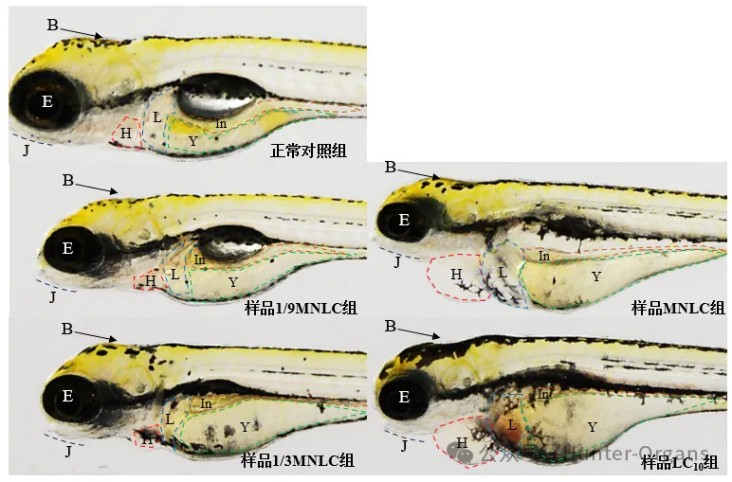
图4. 斑马鱼胚胎急性毒性表型图(注:B=脑;H=心脏;J=下颌;In=肠道;L=肝脏;Y=卵黄囊;E=眼睛)
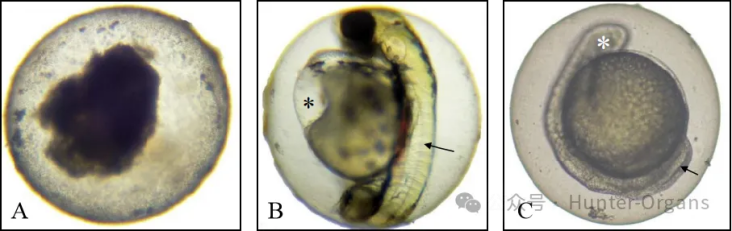
图5. 斑马鱼早期发育阶段的致死指标代表图。A:卵凝结;B:心包水肿(*),←所指为体节;C:尾部未分离(←)和眼芽缺失(*)。图片来自OECD 236(2013)。
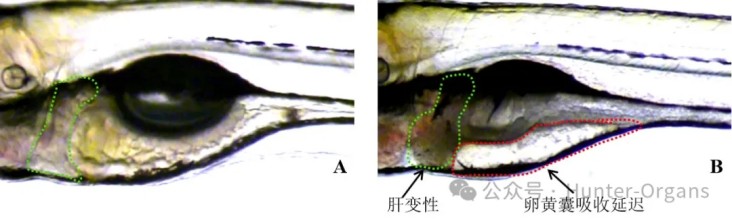
图6. 斑马鱼肝脏局部图。A图为正常斑马鱼,B图斑马鱼出现肝脏发黑(变性)和卵黄囊吸收延迟。绿色虚线所示为肝脏,红色虚线所示为卵黄囊。

图7. 斑马鱼肌肉变性典型图。A图为正常斑马鱼,B图斑马鱼出现肌肉变性(肌肉纹理不清晰、表面不平整、颜色偏暗)。
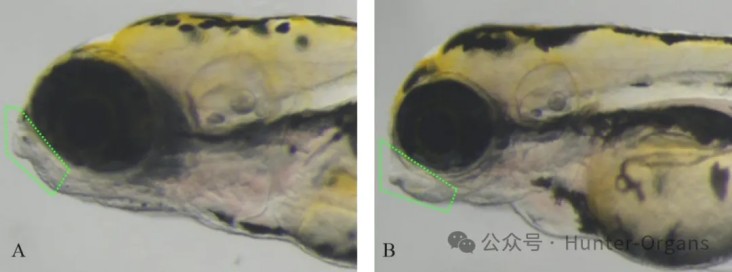
图8. 斑马鱼下颌畸形典型图。A图为正常斑马鱼,B图斑马鱼出现下颌畸形(下颌发育延迟,不能与上颌咬合)
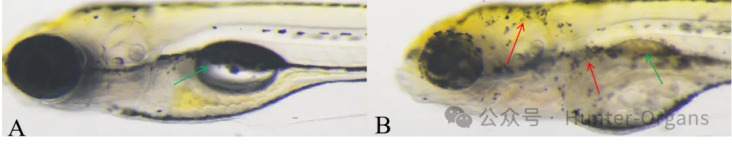
图9. 斑马鱼色素异常典型图和鱼鳔缺失典型图。A图为正常斑马鱼,B图斑马鱼色素异常(红色箭头)和鱼鳔缺失(绿色箭头标记)。
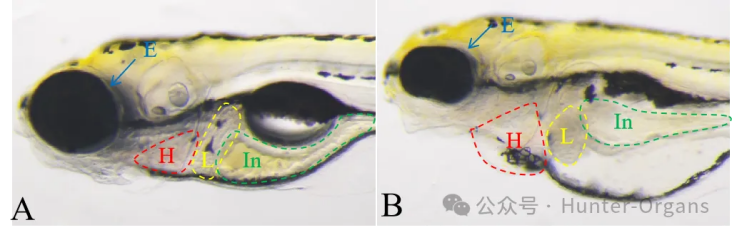
图10. 斑马鱼眼睛变小,心包水肿,肝变性,肠道异常典型图。A图为正常斑马鱼,B图斑马鱼眼睛变小(蓝色箭头)、心包水肿(红色虚线)、肝变性(黄色虚线)和肠道异常(绿色虚线)。
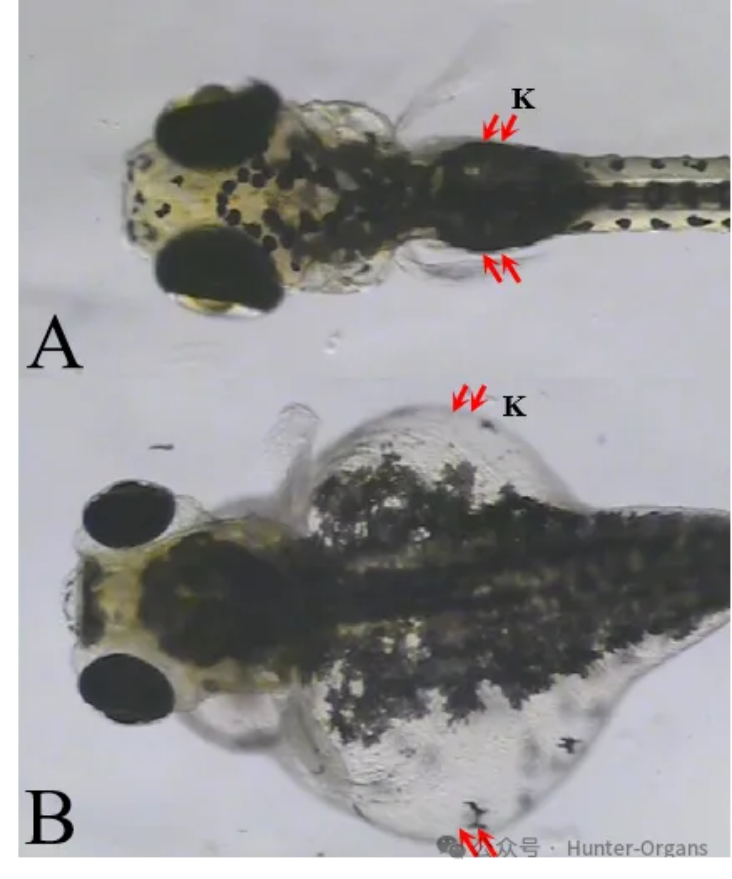
图11. 斑马鱼肾性水肿典型图。A图为正常斑马鱼,B图肾性水肿(红色箭头)。
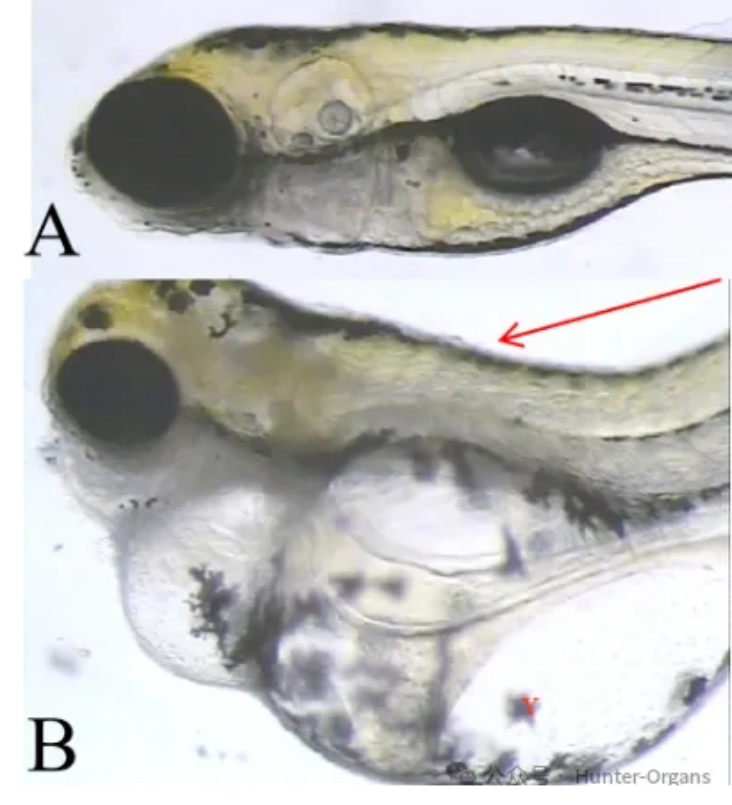
图12. 斑马鱼身体弯曲典型图。A图为正常斑马鱼,B图身体弯曲(红色箭头)。

图13. 斑马鱼体长变短和心包水肿典型图。A图为正常斑马鱼,B图体长变短和心包水肿(红色虚线)。
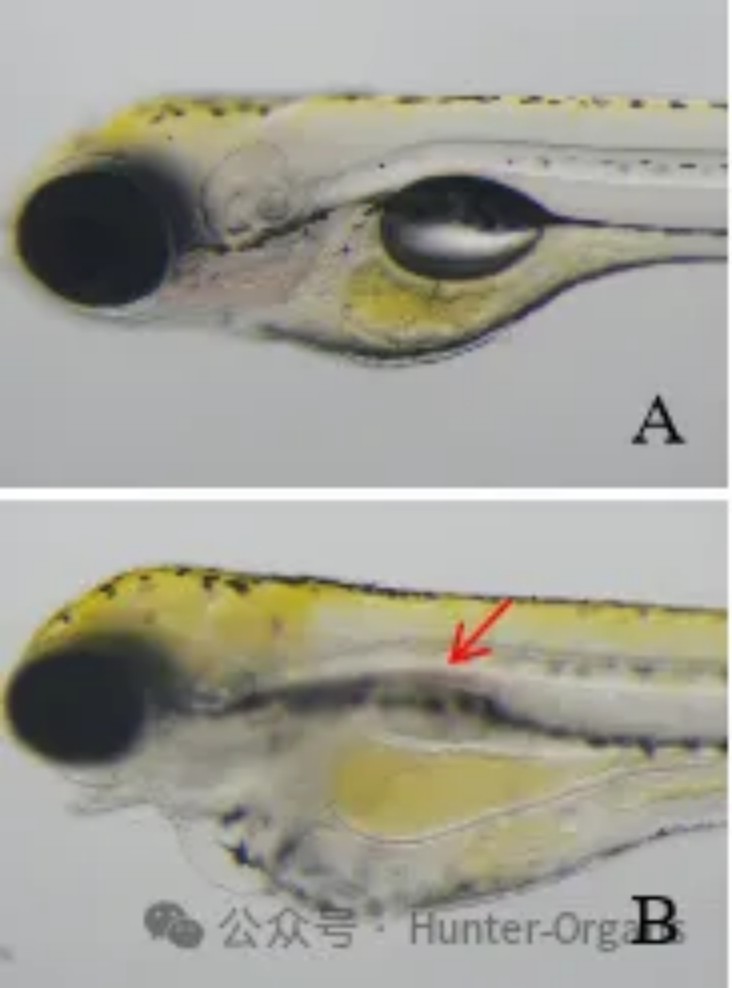
图14. 斑马鱼出血典型图。A图为正常斑马鱼,B图出血(红色箭头)。
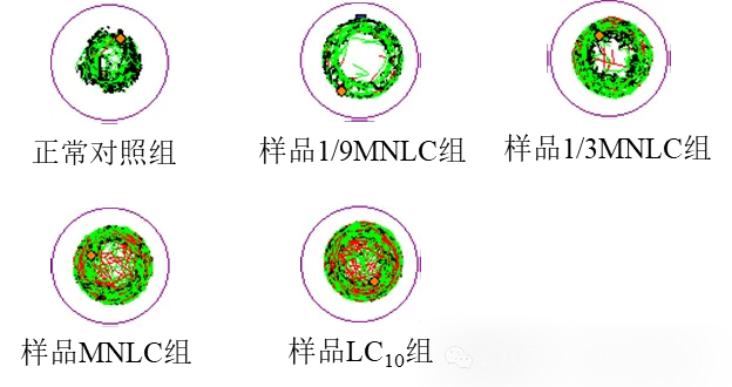
图15. 运动轨迹典型图(注:黑色线为慢速运动距离、绿色线为中速运动距离、红色线为快速运动距离)
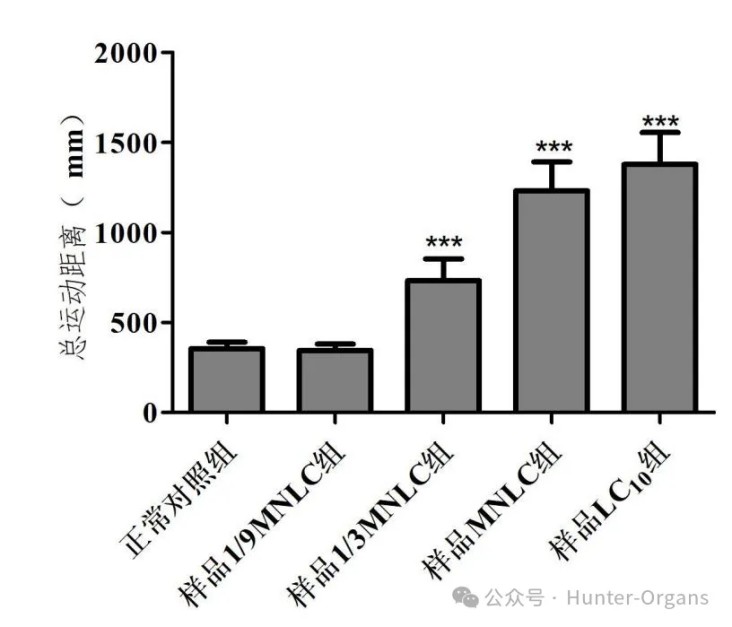
图16. 总运动距离,与正常对照组相比,***p < 0.001
【参考文献】
[1]OECD (2013) Fish Embryo Acute Toxicity (FET) Test. Test Guideline No. 236, Guidelines for the Testing of Chemicals, OECD[S].
[2]Scholz S, Fischer S, Gündel U, et al. The zebrafish embryo model in environmental risk assessment--applications beyond acute toxicity testing[J]. Environ Sci Pollut Res Int. 2008, 15(5):394-404.
[3]Zhang Y, Xia Q, Wang J, et al. Progress in using zebrafish as a toxicological model for traditional Chinese medicine[J]. J Ethnopharmacol. 2022, 282:114638.
[4]Blanco-Sánchez B, Clément A, Phillips JB, et al. Zebrafish models of human eye and inner ear diseases[J]. Methods Cell Biol. 2017, 138:415-467.
[5]Flores EM, Nguyen AT, Odem MA, et al. The zebrafish as a model for gastrointestinal tract-microbe interactions[J]. Cellular Microbiology, 2022, 22: e13152.
[6]Shen B, Liu HC, Ou WB, et al. Toxicity induced by Basic Violet 14, Direct Red 28 and Acid Red 26 in zebrafish larvae[J]. J Appl Toxicol. 2015, 35(12): 1473-1480.
[7]Feng N, Bian Z, Zhang X, et al. Rapamycin reduces mortality in acute-stage paraquat-induced toxicity in zebrafish[J]. Singapore Med J. 2019, 60(5): 241-246.
[8]Jayasinghe CD, Jayawardena UA. Toxicity Assessment of Herbal Medicine Using Zebrafish Embryos: A Systematic Review[J]. Evid Based Complement Alternat Med. 2019, 7272808.