业务咨询

![]() 发布时间:2025-09-22
发布时间:2025-09-22
![]() 环特生物
环特生物
![]() 浏览次数:4
浏览次数:4
编者按
前列腺癌是全球范围内最常见且致死率较高的恶性肿瘤之一,其发病率呈现持续上升趋势,尤其是SPOP突变型前列腺癌,其治疗选择有限,且易产生耐药性。近年来,铁死亡诱导剂在前列腺癌中已显示出治疗潜力,但肿瘤的异质性阻碍了其疗效。理解癌细胞对铁死亡的抵抗机制,是克服耐药性的关键。
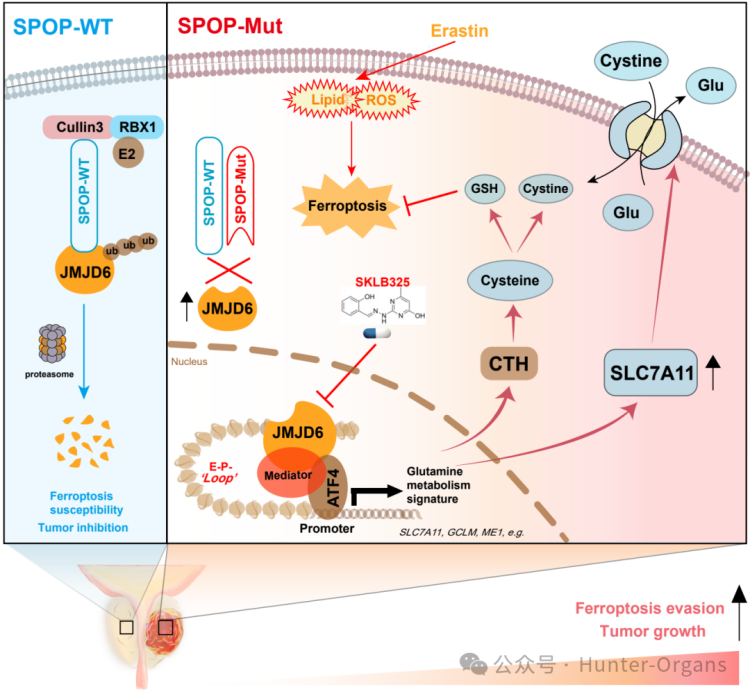
近期,上海交通大学附属瑞金医院泌尿外科研究团队、中国科学技术大学张传杰教授课题组联合在Cancer Research(IF=12.5)上发表最新研究,首次揭示了JMJD6蛋白在SPOP突变型前列腺癌中,通过重塑表观遗传机制,激活谷胱甘肽代谢通路,从而赋予癌细胞对铁死亡的强大抵抗性的新机制,并通过斑马鱼PDX、类器官等实验证实了JMJD6抑制剂与铁死亡诱导剂联合使用是一种有效的治疗策略,为前列腺癌的治疗提供了新的靶点。
本研究中,环特生物提供的斑马鱼PDX、类器官实验服务支持,多维度验证了靶向JMJD6的小分子抑制剂SKLB325能够与铁死亡诱导剂协同作用,有效抑制SPOP突变前列腺癌的生长,为SPOP突变型前列腺癌的精准治疗提供了新的理论基础和实验依据。(开学季福利丨环特科研预存福利大礼包全新升级,速来解锁!)
01、研究亮点
首次发现JMJD6是锌指结构蛋白(SPOP)的底物,证实了SPOP负责降解JMJD6,而PCa中常见的SPOP突变会导致JMJD6蛋白异常积累;
通过基因编辑技术、免疫共沉淀(Co-IP)等,揭示了SPOP–JMJD6–ATF4–谷胱甘肽轴在前列腺癌(PCa) 铁死亡抵抗中的核心作用,JMJD6在SPOP突变型前列腺癌中通过表观遗传机制调控谷胱甘肽代谢,从而赋予铁死亡抵抗性;
利用斑马鱼PDX模型、患者来源的类器官、细胞系、小鼠异种移植模型等多种模型,多维度验证了JMJD6抑制剂SKLB325与铁死亡诱导剂(erastin)的协同抗瘤效果,提出了靶向JMJD6的表观遗传治疗策略。
图形摘要
02、主要研究成果
1. 高表达JMJD6蛋白水平,而非mRNA水平,与PCa患者的不良预后相关
研究人员通过临床样本分析发现,14对PCa患者的肿瘤组织及其配对正常组织中,12/14 (86%)肿瘤组织的JMJD6蛋白水平显著高于正常组织。免疫组织化学(IHC)结果显示,450例PCa样本的组织微阵列(TMA)中,肿瘤组织中的JMJD6表达显著高于正常组织。JMJD6免疫染色强度随Gleason评分、TNM分期、病理分期升高而增加。因此,JMJD6蛋白水平升高与PCa患者的不良预后相关。
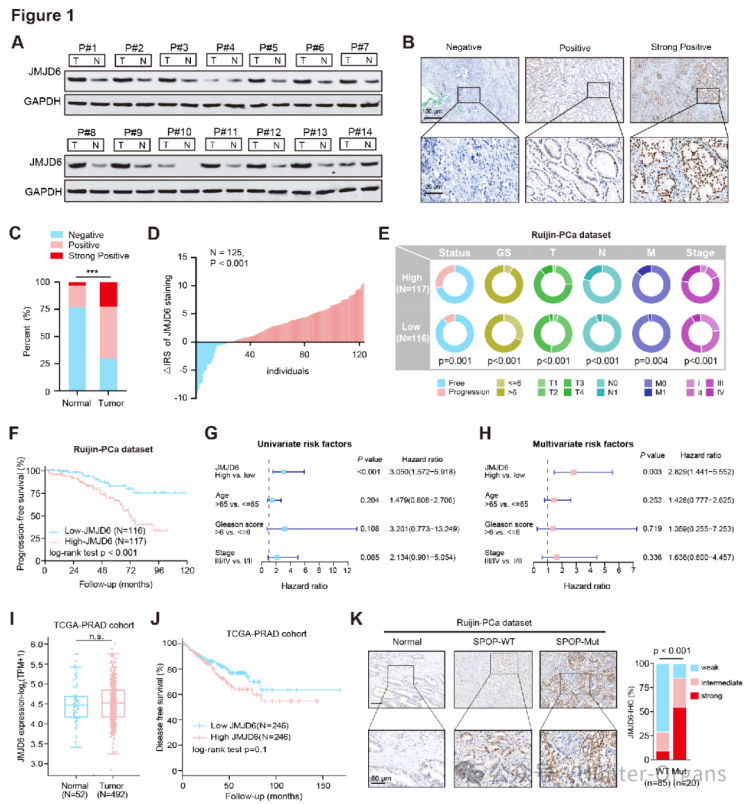
图1
2. 与前列腺癌相关的SPOP突变体会导致JMJD6蛋白积累
研究人员通过免疫共沉淀和相关突变实验,证实了SPOP与JMJD6的相互作用,JMJD6通过特定的SBC基序(GDTTS)与SPOP结合。随后,研究人员又利用基因编辑技术和蛋白酶体抑制剂,发现SPOP是E3泛素连接酶适配蛋白,其突变在PCa中常见(约15%),首次证明了SPOP负责降解JMJD6,而PCa中常见的SPOP突变,如Y87N、F125V或F133L等,会破坏其与JMJD6的结合,导致JMJD6蛋白的降解和泛素化过程受损,使JMJD6蛋白在细胞内异常积累,且共表达SPOP突变体还会抑制野生型SPOP介导的JMJD6泛素化和降解。
此外,通过体内泛素化实验等方法,进一步证实了SPOP 对 JMJD6 的调控作用,发现JMJD6在SBC基序上的肿瘤相关突变可使其逃避SPOP介导的泛素化。总之,研究表明PCa相关的SPOP突变及JMJD6在SBC基序上的肿瘤相关突变,均会导致JMJD6蛋白异常积累。
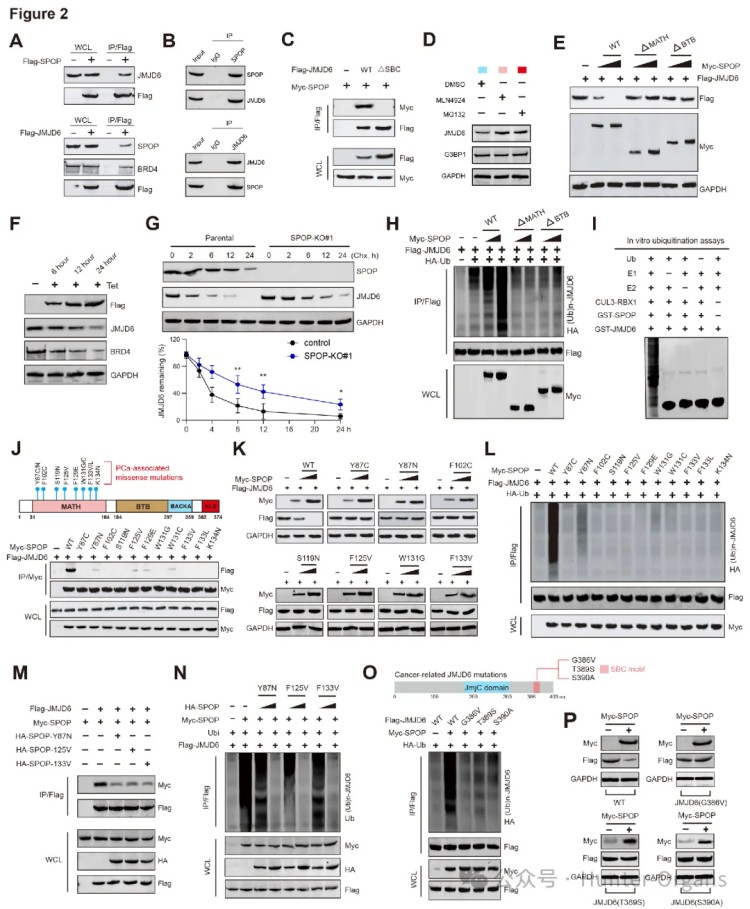
图2
3. 不依赖于雄激素受体(AR),JMJD6 蛋白水平升高与肿瘤侵袭性相关,且对SPOP突变型前列腺癌(PCa)是必需的
接着,研究人员构建了2个JMJD6基因敲低(JMJD6-KD)PCa细胞亚系,发现JMJD6-KD显著抑制了PCa细胞的增殖速率;利用小鼠异种移植实验,发现JMJD6-KD单独处理可抑制肿瘤生长,进一步削弱SPOP-KD诱导的PCa体内侵袭性;(SPOP-F133V)C4-2细胞构建的原位PCa模型实验结果显示,JMJD6-KD可显著降低肿瘤生长,生物发光成像(BLI)也证实了这一结果;胫骨内注射实验显示,JMJD6-KD极大地减少了肿瘤细胞在骨骼的定植,BLI信号及相关染色结果也证实了这一点。利用(SPOP-Y87N)C4-2细胞构建的原位或骨侵蚀PCa模型,也得到了相似结果。
研究人员还构建了前列腺特异性双等位基因敲除小鼠模型,发现双等位基因敲除SPOP导致前列腺上皮内瘤变(PIN)发生率增加,且前列腺质量、Ki67阳性率和JMJD6染色水平均显著上升。在小鼠前列腺癌类器官模型中观察到,敲除Spop促进了类器官生长,而JMJD6-KD则显著削弱了Spop缺陷型前列腺类器官的克隆潜能,通过类器官大小、Caspase-3染色水平和Ki67阳性细胞的量化分析得到证实。而在人前列腺癌类器官模型中也观察到,JMJD6-KD显著抑制了SPOP突变的PCa类器官的增殖,JMJD6-KD对由c-Myc过表达(OE)或AR过表达驱动的肿瘤发生能力没有显著影响。总之,这些数据凸显了JMJD6的重要功能,且JMJD6的酶活性对其驱动PCa的作用至关重要。
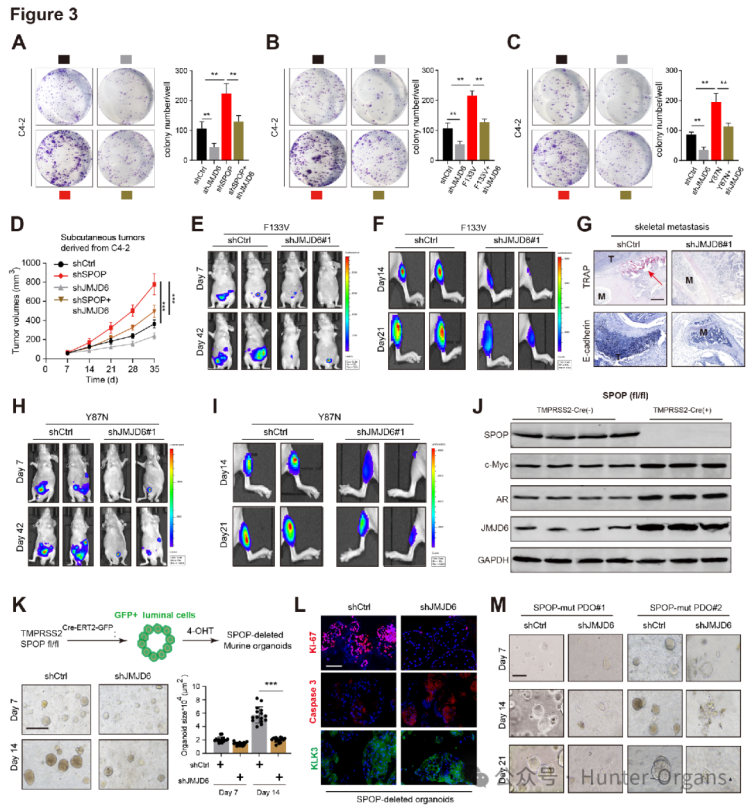
图3
4. JMJD6与ATF4协同激活GSH合成通路,且JMJD6招募Mediator复合物组装新增强子
接着,研究人员通过RNA-seq分析及基因集富集分析(GSEA)发现,敲低JMJD6后,差异表达基因主要与TNF信号通路、JAK-STAT信号通路、细胞因子-细胞因子受体相互作用及谷胱甘肽代谢相关。升高的JMJD6与转录因子ATF4协同作用,通过形成增强子-启动子环,来刺激谷胱甘肽(GSH)生物合成通路。因此,GSH是细胞抵抗氧化应激和铁死亡的关键分子。
随后,研究人员通过染色质免疫沉淀测序(ChIP-seq)技术,确定了JMJD6结合的增强子位点特征,发现在SPOP突变的PCa细胞中,JMJD6和ATF4与核心中介体复合物成分(Med1、Med14)相关。免疫共沉淀(Co-IP)实验结果显示,JMJD6与核心中介体复合物成分相关,且JMJD6缺失会破坏ATF4与Med1/14关联。JMJD6和ATF4通过与Med1/14相互作用,部分增强子区域JMJD6信号增加,形成新的超级增强子(SEs),且多数SEs也被ATF4结合。这些增强子有效地激活与GSH代谢相关的关键基因,如SLC7A11、GCLM、ME1等的转录,通过直接调控这些基因的表达,可以促进GSH合成。
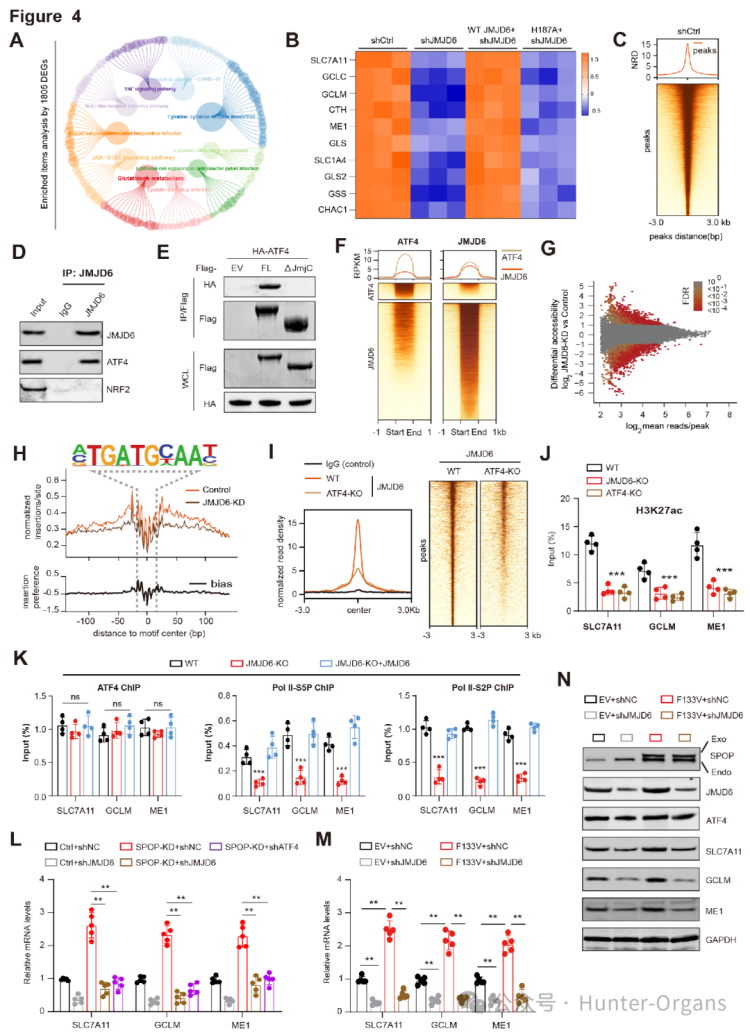
图4
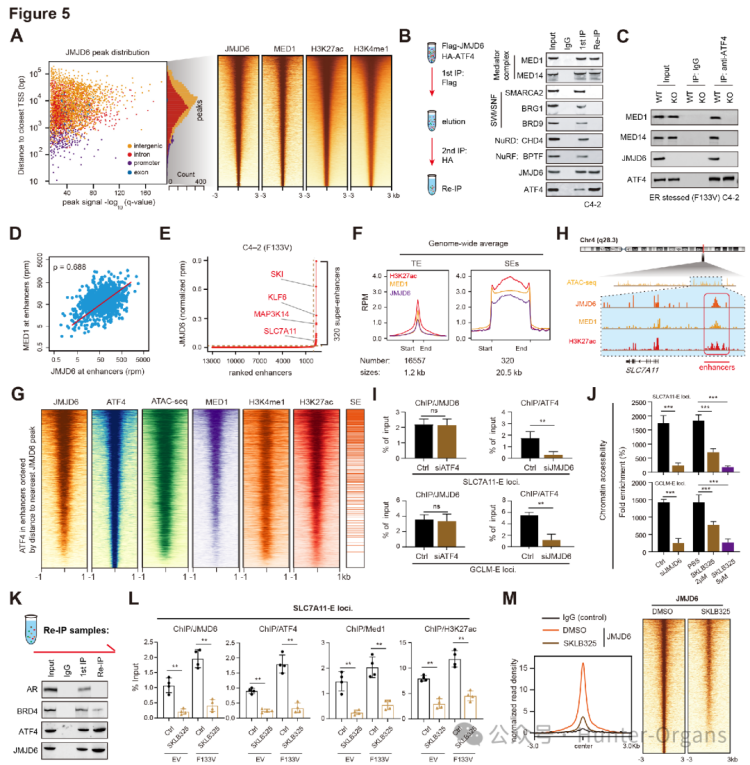
图5
5. JMJD6增强ATF4驱动的胱氨酸摄取,并抑制SPOP突变PCa中的铁死亡
SLC7A11是谷胱甘肽生物合成及摄取细胞外胱氨酸的重要物质。JMJD6或ATF4的缺失会抑制胱氨酸的摄取,降低GSH的水平,并提高erastin诱导的细胞死亡。与缺陷型JMJD6(H187A)相比,重新表达野生型JMJD6或SLC7A11能完全恢复这些指标。敲低JMJD6显著增强了erastin诱导的细胞死亡,而这种死亡可以通过铁死亡抑制剂(ferrostatin或DFO)完全挽救,但通过caspase抑制剂或坏死性凋亡抑制剂则无法实现。同样地,异位表达野生型SPOP也复制了JMJD6敲除细胞的表型,而JMJD6的异位表达则逆转了这些效应。
研究还发现,SPOP突变型PCa细胞对erastin等铁死亡诱导剂具有抵抗性,JMJD6缺失或抑制可恢复其对铁死亡的敏感性。相对于野生型 SPOP,所有SPOP突变体都无法促进erastin或胱氨酸耗竭诱导的铁死亡,而异位过表达SPOP突变体使C4-2细胞对铁死亡产生抗性。在缺失JMJD6时,ATF4单独无法有效激活谷胱甘肽代谢相关信号,这有力地证明了SPOP/JMJD6轴在调控PCa铁死亡中的作用。研究人员还发现,SPOP突变体的PCa细胞对SKLB325更敏感,而良性或非肿瘤性前列腺细胞受影响较小。SKLB325可抑制PCa细胞生长并诱导铁死亡介导的细胞死亡,但在JMJD6基因敲除的细胞中,SKLB325几乎没有诱导作用。
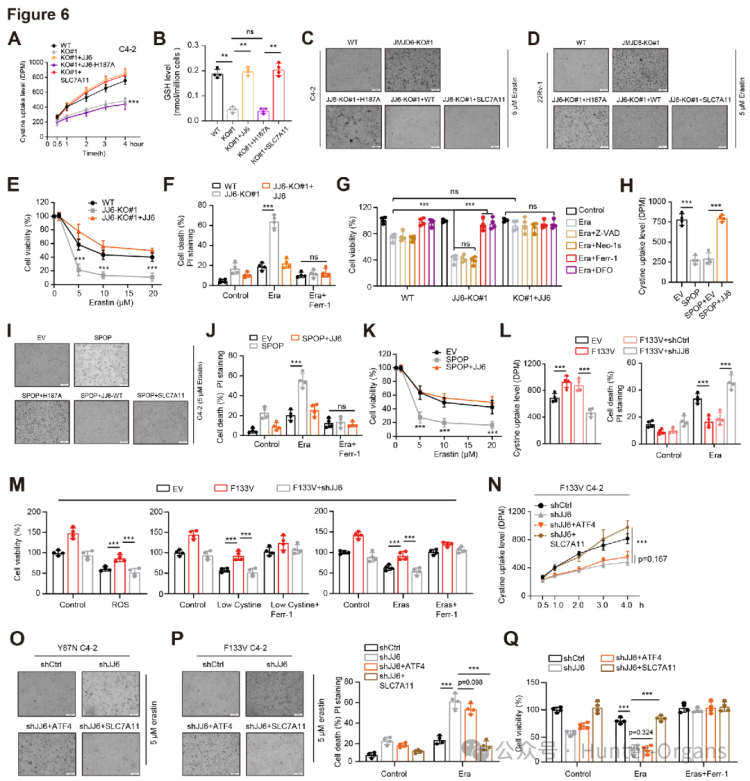
图6
随后,研究人员采用药理学BLISS法,证实了Erastin与JMJD6抑制剂SKLB325的联合(Combo)抗癌作用。SKLB325 和erastin在多种PCa细胞系中具有协同作用。SKLB325联合erastin可显著上调SPOP突变前列腺癌细胞对铁死亡的敏感性,并抑制细胞生长。
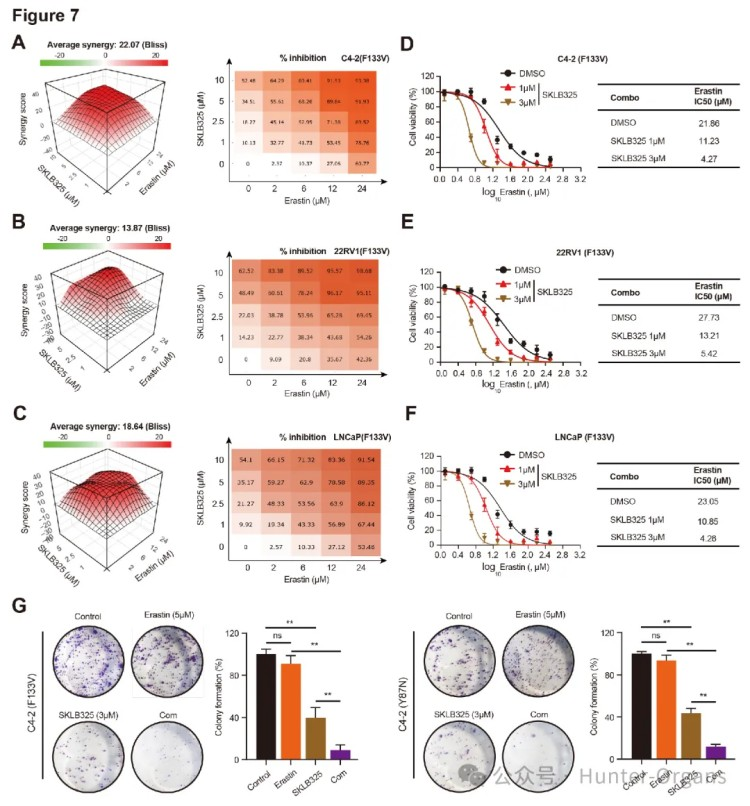
图7
6. SKLB325和铁死亡诱导剂协同作用,抑制前列腺癌临床前模型中的肿瘤生长
随后,研究人员利用裸鼠皮下成瘤、原位前列腺癌、人源类器官、人源PDX及斑马鱼PDX等多种体内模型,充分证实了SKLB325与erast联用,可协同诱导铁死亡,有效遏制SPOP突变前列腺癌的增殖、转移及铁死亡抵抗。
裸鼠皮下成瘤实验结果显示,SKLB325对高表达JMJD6的肿瘤生长抑制效果显著,而对JMJD6缺失的PDX3肿瘤则几乎没有作用,表明JMJD6的表达状态是SKLB325对SPOP突变PCa治疗效果的关键因素;原位前列腺肿瘤模型中,生物发光成像(BLI)及肿瘤重量、体积量化结果显示,联合治疗组肿瘤增殖明显减少,而单独使用SKLB325对肿瘤的影响较为温和,表明SKLB325与erastin联合使用在抑制原位前列腺肿瘤生长方面效果更优。而且,联合治疗组的许多肿瘤细胞含有肿胀的线粒体,且膜密度增加,这是铁死亡的典型形态特征,进一步证实了联合治疗能够诱导肿瘤细胞发生铁死亡。
斑马鱼PDX模型实验结果显示,联合治疗策略能够抑制肿瘤细胞的恶性程度和远端转移灶的数量,表明联合治疗在斑马鱼模型中同样能有效抑制肿瘤生长和转移。通过构建前列腺癌类器官模型,对单个患者来源的类器官进行单药或联合治疗测试,结果显示,SPOP突变的类器官对不同处理有不同反应,用erastin处理的类器官持续生长,而联合治疗组的类器官大小和Ki67阳性染色水平逐渐下降,再次证明联合治疗对SPOP突变的PCa类器官具有显著的抑制作用。
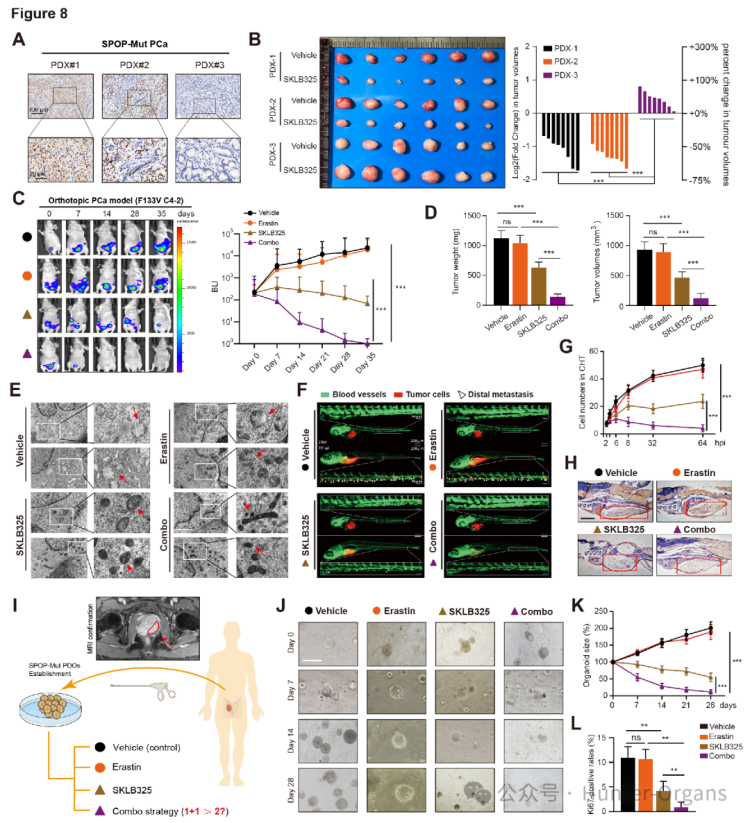
图8
本研究中,环特生物提供了斑马鱼PDX、类器官等实验服务支持,多维度验证了靶向JMJD6的小分子抑制剂SKLB325能够与铁死亡诱导剂协同作用,有效抑制SPOP突变前列腺癌的生长。为了更好地助力科学研究,环特生物依托国际领先的斑马鱼、类器官、哺乳动物、人体临床等多维生物技术服务平台,现推出“开学季-科研预存大礼包”活动,致力于成为您科研路上最值得信赖的伙伴!欢迎新老客户咨询!
详情请点击:开学季福利丨环特科研预存福利大礼包全新升级,速来解锁!
03、编者点评
本研究深入揭示了JMJD6在SPOP突变型前列腺癌中的作用机制,发现了SPOP–JMJD6–ATF4–谷胱甘肽轴在PCa铁死亡抵抗中的核心作用,并提出了靶向JMJD6的表观遗传治疗策略,为SPOP突变型前列腺癌的精准治疗提供了新的理论基础和实验依据。通过靶向JMJD6,有望打破癌细胞对铁死亡的抵抗力,也为开发针对PCa的新疗法提供了理论基础。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、基因编辑、类器官、哺乳动物、人体”等多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,脑类器官、胃癌、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!
参考文献:
Chuaniie Zhang,Jiawei Ding, et al. JMJD6 Rewires ATF4-Dependent Glutathione Metabolism to Confer Ferroptosis Resistance in SPOP-Mutated Prostate Cancer. Cancer Research. 2025. DOI: 10.1158/0008-5472.CAN-23-2796