业务咨询

![]() 发布时间:2023-10-13
发布时间:2023-10-13
![]() 环特生物
环特生物
![]() 浏览次数:4308
浏览次数:4308

编者按
宫颈癌曾是世界上最致命的癌症,但自从发现人类乳头瘤病毒(HPV)感染在癌症发病机制中的作用并制定成功的筛查策略以来,宫颈癌死亡率已大幅下降。宫颈癌最常见的亚型是鳞状细胞癌(SqCa)和腺癌(AdCa),分别占所有病例的70%和25%,这些肿瘤发生于宫颈的外口、内口和转化区。目前,宫颈癌研究主要依赖于细胞系和异种移植,但大多数细胞系经过多次传代后在临床前测试中的价值有限,而基于宫颈癌的异种移植模型成功率较低。
在过去十年中,以成体干细胞为基础的器官组织培养取得了很大进展。受影响个体的肿瘤可作为三维类器官进行培养,正常类器官则可通过使用CRISPR技术有序地引入致癌突变来驱动恶性转化。类器官技术现已扩展到多种妇科组织和肿瘤,今天我们解读一项于2021年8月发表在《Cell Stem Cell》的最新研究,该研究报告了从健康的宫颈外阴、内口组织及相关的恶性肿瘤组织中建立长期稳定类器官的培养方法。
一、主要研究成果
1、正常宫颈类器官的衍生和HSV-1感染
从接受全子宫切除术妇女的宫颈管中分离出正常的宫颈内口和宫颈外口组织,使用消化酶进行消化,将得到的细胞进行类器官构建,宫颈内膜类器官形成中空的囊状结构,而宫颈外膜类器官则表现出致密的表型。用tdTomato标记的生殖器单纯疱疹病毒1型(HSV-1)感染宫颈外口和宫颈内口类器官系,在暴露24小时后,两个系都出现了清晰的荧光信号,表明感染成功。在感染后一周内观察到病毒DNA含量大幅增加,证实病毒能够在两种类型的类器官中轻松复制。
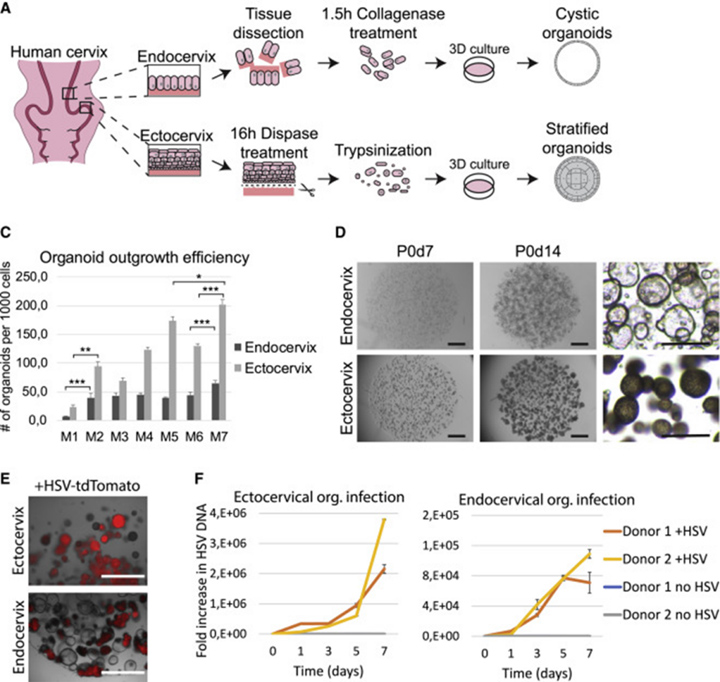
图1
2、宫颈内、外器官类器官与原生组织的结构功能相近
宫颈内、外上皮显示出不同的形态和转录特征。宫颈内膜是一种腺单层上皮,具有明显的分泌特性,主要功能是提供粘液润滑宫颈管;分层的宫颈外口结构由基底细胞维持,基底细胞经过增殖和分化形成动态的多层鳞状上皮,主要起保护作用。
分析两个类器官系的基因表达谱和组织学特性,并将其与各自的原发组织进行比较,主成分分析(PCA)结果显示,类器官和各自原发组织的基因表达模式相似,在长期传代过程中,两种类器官转录表达稳定。RNA-seq结果显示宫颈内膜相应的组织和类器官均可表达多种粘液蛋白;宫颈外口则显示出独特的角质化相关基因特征,表达了大量不同的角蛋白,意味着宫颈组织和类器官之间有类似的分层程序。
此外,早期传代和晚期传代的类器官之间遗传特征保持不变;H&E染色显示宫颈内膜类器官呈极化单层结构,宫颈外膜类器官则呈分层多层表型,两者都与各自的原生组织相似。
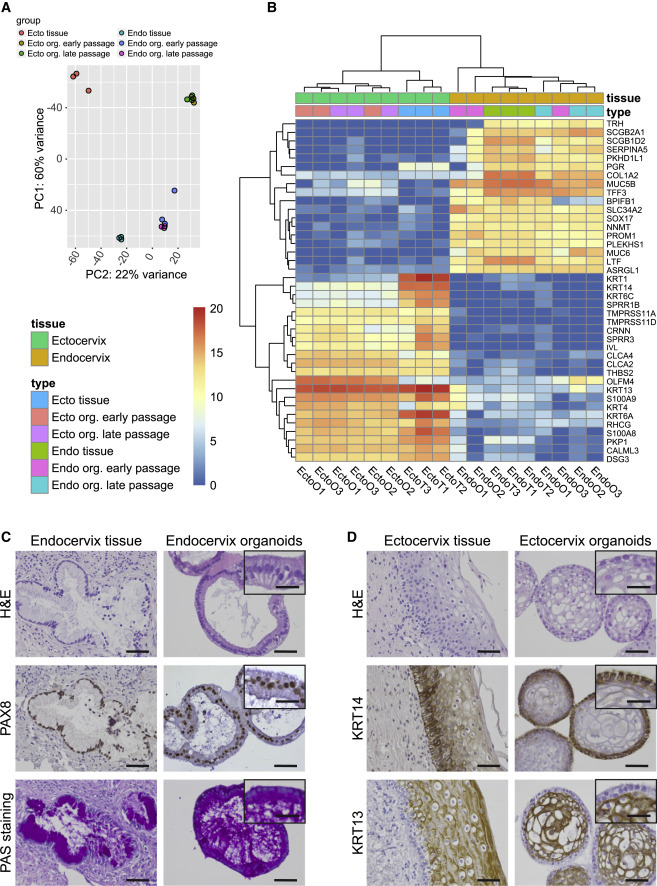
图2
3、从巴氏涂片组织中构建宫颈肿瘤类器官
巴氏试验被引入临床后,对早期快速诊断宫颈异常起到了重要作用。由于通过巴氏刷法收集材料无法从肿瘤病灶中获得足够的细胞材料,使用这种方法在SqCa中衍生的肿瘤类器官成功率约为50%,在AdCa中约为25%。衍生出的类器官形态各异,从致密到囊性不等。肿瘤类器官可扩增至少1.5年,并表现出不同程度的染色体不稳定性。
SqCa衍生的类器官在培养过程中显示出致密的形态,组织形态上表现出分层丧失和细胞极性差的特征,正常的基底细胞限制性标记物TP63及增殖生物标记物MKI67在整个SqCa肿瘤组织中大量表达,分化标记物KRT13的表达减少。AdCa衍生肿瘤类器官显示出更密集的结构和突出的空泡化,PAX8染色及增殖生物标志物MKI67也显示出强阳性,证实了其来源于宫颈内膜且能确定疾病的程度。
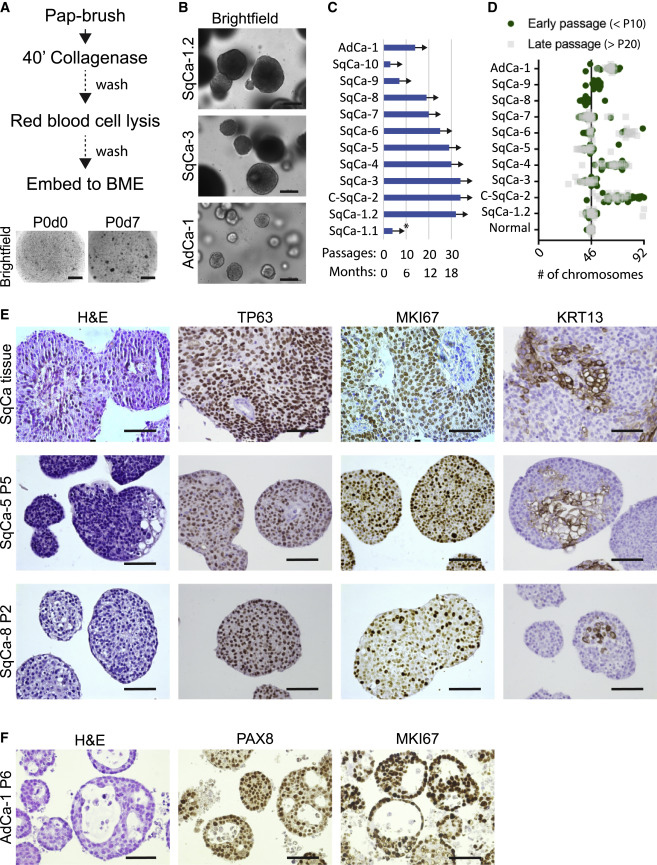
图3
4、SqCa衍生的肿瘤类器官的肿瘤相关基因表达
对正常的宫颈外口和宫颈内口以及肿瘤衍生的类器官转录组分析,结果显示不同组织间存在明显的差异,肿瘤类器官系形成了一个独立的群组。肿瘤类器官的基因表达谱在长期传代过程中高度稳定。与正常类器官相比,SqCa衍生的肿瘤类器官有289个基因被显著上调,814个基因显著下调。提取肿瘤类器官组中明显上调的前20个基因得到了与宫颈癌相关的基因列表,其中CDKN2A(编码p16INK4a蛋白的基因)在免疫染色实验中得到证实。
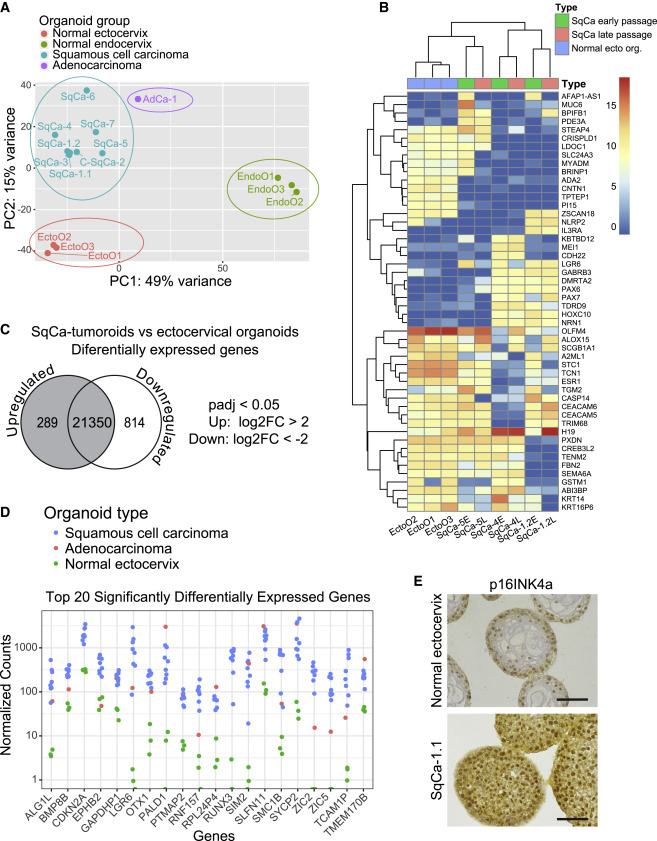
图4
5、肿瘤类器官异种移植时的特征
将4个的肿瘤类器官分别注射到免疫缺陷小鼠的左右两侧腹部皮下,结果显示肿瘤大小的变化与癌种类型有关,AdCa衍生的肿瘤生长最快。免疫组化结果显示SqCa-s表现出不同程度的鳞状分化,正常的宫颈外口组织可观察到向邻近基质组织的浅表延伸,表明肿瘤具有侵袭性。
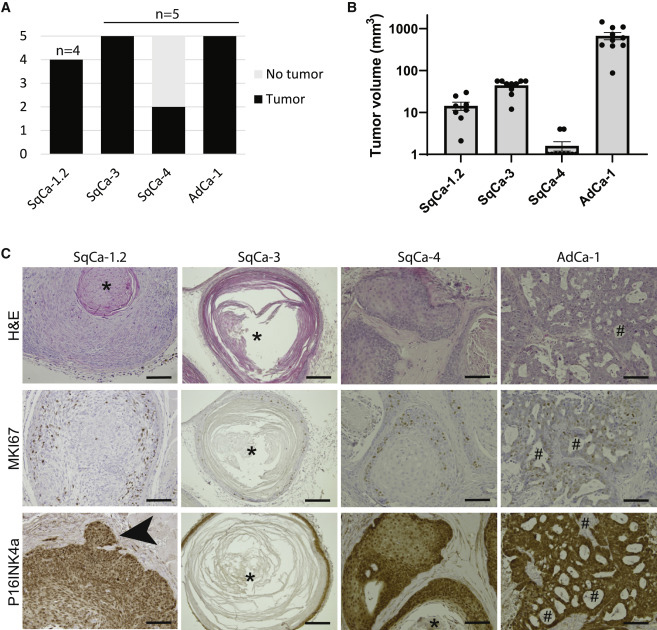
图5
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展科研服务CRO、智慧实验室建设和精准医疗三大业务。目前,环特类器官平台已建立肝癌、胰腺癌、胃肠癌、宫颈癌及子宫内膜癌等多种肿瘤类器官模型,并推出免疫疗法治疗抗肿瘤药物的敏感性检测服务,欢迎来电垂询!
参考文献
[1] Horn J , Denecke A , Luyten A ,et al.Reduction of cervical cancer incidence within a primary HPV screening pilot project (WOLPHSCREEN) in Wolfsburg, Germany[J].British Journal of Cancer[2023-09-12].
[2] Isidean S D ,Marie-Hélène Mayrand, Ramanakumar A V ,et al.Human papillomavirus testing versus cytology in primary cervical cancer screening: End-of-study and extended follow-up results from the Canadian cervical cancer screening trial[J].International Journal of Cancer, 2016.
[3] Ronco G , Dillner J , Elfstrm K M ,et al.Efficacy of HPV-Based Screening for Prevention of Invasive Cervical Cancer: Follow-up of Four European Randomized Controlled Trials[J].Obstetrical & Gynecological Survey, 2014, 69.
[4] Cohen P , Jhingran A , Oaknin A ,et al.Cervical cancer.[J].Lancet (London, England), 2019, 393(10167):169-182.
[5] Larmour L I , Jobling T W , Gargett C E .A Review of Current Animal Models for the Study of Cervical Dysplasia and Cervical Carcinoma[J].International Journal of Gynecological Cancer, 2015, 25(8):1345-1352.
[6] Corinna,Hoffmann,and,et al.Creation and characterization of a xenograft model for human cervical cancer[J].Gynecologic Oncology, 2010.
[7] Houdt W V .Prospective derivation of a living organoid biobank of colorectal cancer patients[J]. 2015.
[8] Jarno,Drost, Richard H ,et al.Sequential cancer mutations in cultured human intestinal stem cells.[J].Nature, 2015.
[9] Matano M , Date S , Shimokawa M ,et al.Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids[J].Nature Medicine, 2015, 21(3):256-262.