业务咨询

![]() 发布时间:2024-01-26
发布时间:2024-01-26
![]() 环特生物
环特生物
![]() 浏览次数:3609
浏览次数:3609

编者按
由于种间差异,依赖动物试验来预测药物的临床疗效、毒理学等,会造成难以避免的预测偏差,最终导致大量药物开发失败。因此,开发能够准确评估和预测候选药物对人肝组织毒性和疗效的体外肝脏细胞模型迫在眉睫。源于人多能干细胞的人肝脏类器官(HLO)为此提供了一种潜在的解决方案。
今天,我们特别关注一项中国科学院上海营养与健康研究所丁秋蓉研究团队于2023年3月发表在《Cell Regeneration》的研究——《Modeling drug-induced liver injury and screening for anti-hepatofibrotic compounds using human PSC-derived organoids》,该研究将人多能干细胞衍生的肝脏类器官作为了学术研究和个性化医疗的临床前模型,通过诱导人多能干细胞定向分化,构建HLO作为药物性肝损伤模型,并用于筛选抗肝纤维化化合物,并揭示出HLO在药物安全性测试和抗纤维化药物筛选中的潜在应用。
论文翻译:张净月
01、研究背景
新药研发的高失败率,主要原因是严重依赖动物实验获得的临床前数据。许多研究证明了人体特有的生物过程,无法用动物模型来模拟。例如,人和动物的肝脏细胞色素P450(CYP)酶不同[1],因此动物对有毒物质的敏感性与人类不同。最近的一项研究首次比较了动物和人类研究中的靶器官毒性,也发现了人类和动物之间药物诱发肝损伤(DILI)的一致性较低[2]。由于人体模型与动物模型之间缺乏生理相关性,因此迫切需要开发源于人体的体外细胞模型来研究药物的毒性和疗效。
最近报道了由多能干细胞(PSCs)产生的人类肝脏类器官(HLOs),其中包括多种细胞类型,包括肝细胞、肝星状细胞和kupffer细胞[3]。这些HLOs能够模拟游离脂肪酸治疗或某些基因的遗传突变诱导的脂肪性肝炎以及药物诱导的胆汁淤积症[4]。因此作者用已知可引起不同表型的DILI的化合物处理HLOs,并证明了HLOs在人类风险评估中的作用。并进一步设计了一种用于纤维化分析的高内涵分析(HCA)系统,并开发了一种使用HLOs的高通量抗纤维化药物筛选系统。综上所述,作者的研究表明,HLOs可以应用于DILI造模和药物筛选。
02、主要研究成果
1、hPSC衍生的人肝类器官的功能表征
作者参照之前的方案[3][4]将hPSC诱导为HLO:hPSCs最初分化成前肠球体,然后用视黄酸(RA)进行3D培养,以实现实质细胞和非实质细胞的分化,接着在肝脏成熟培养基中进一步培养。另外,前肠细胞也可以用Accutase分散成单细胞,然后在由成纤维细胞生长因子2(FGF2)、血管内皮生长因子(VEGF)、表皮生长因子(EGF)、CHIR99021(糖原合酶激酶3抑制剂)和A83-01(转化生长因子-β抑制剂)与抗坏血酸等5种因子组成的培养基(称为“5F”法)中扩增,再进行RA处理和进一步培养。
此外,白蛋白分泌和几个肝脏标记基因(ALB、CYP3A4、CYP2B6、CYP2E1)的表达水平分析表明,5F法衍生的HLOs含有更多成熟的肝细胞。胆管细胞标记物(SOX9)和星状细胞标记物(PDGFRβ)的免疫荧光分析进一步证明了HLOs中存在多种细胞类型。
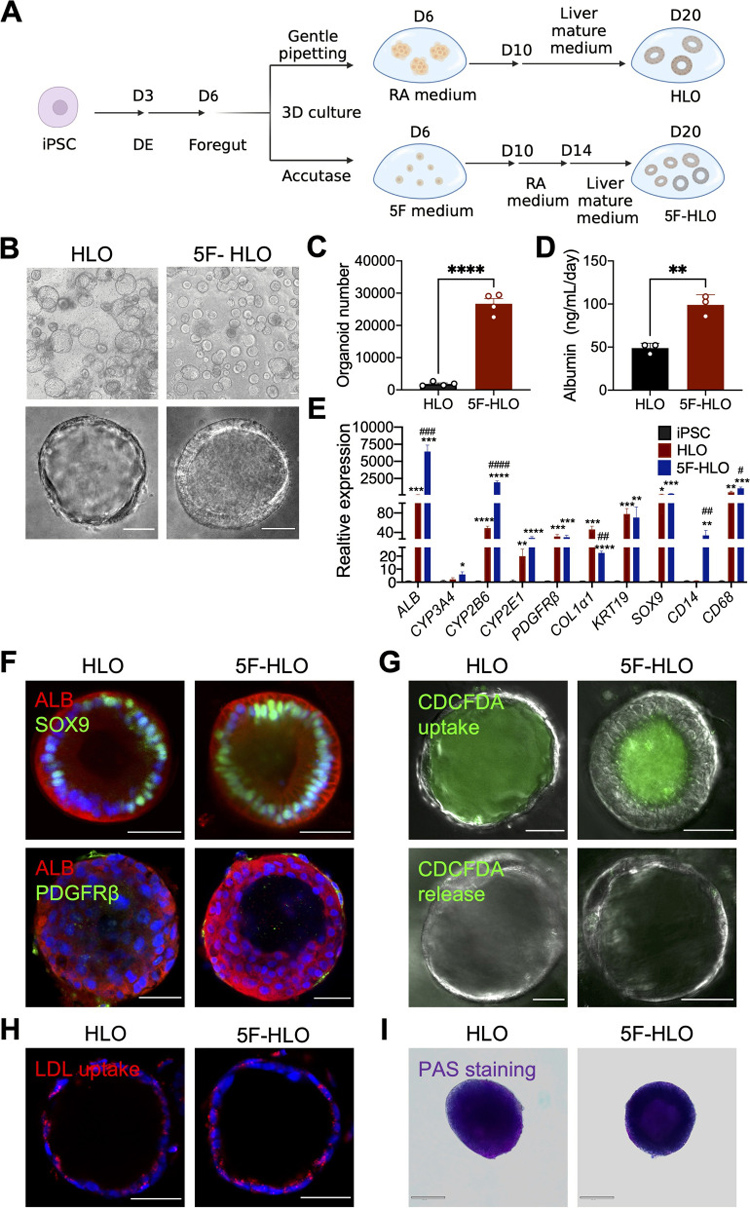
原文图1 来源于hPSC的人肝类器官的功能表
2、使用HLO对具有不同表型的DILI进行建模
作者为了进一步评估这些HLOs是否可以用于模拟不同毒素引起的DILI,因此对其进行了不同药物的造模。HepG2是一种肝细胞癌细胞系,通常被用作体外肝脏毒性模型,在这里被用作对照[5]。对乙酰氨基酚(APAP)是一种用于缓解慢性疼痛或退烧的镇痛药,过量服用可直接导致肝细胞损伤并产生DILI。
为了评估APAP对肝脏的毒性,作者用0.5、3或10 mM的APAP分别处理HLO和HepG2球状体7天。用APAP处理HLOs会导致白蛋白分泌和细胞ATP水平显著下降,且呈剂量依赖性。活性氧(ROS)的形成显著增加也证明了APAP处理后GSH消耗导致的氧化应激,萤光探针CellROX的强度增加也揭示了这一点。
而在HepG2球状体中,白蛋白水平在APAP处理后没有明显变化,ATP水平只有在高剂量(10 mM)APAP处理后才出现下降,但也观察到明显的氧化应激。这些结果强调,HLOs比HepG2球状体对APAP诱导的毒性更敏感。
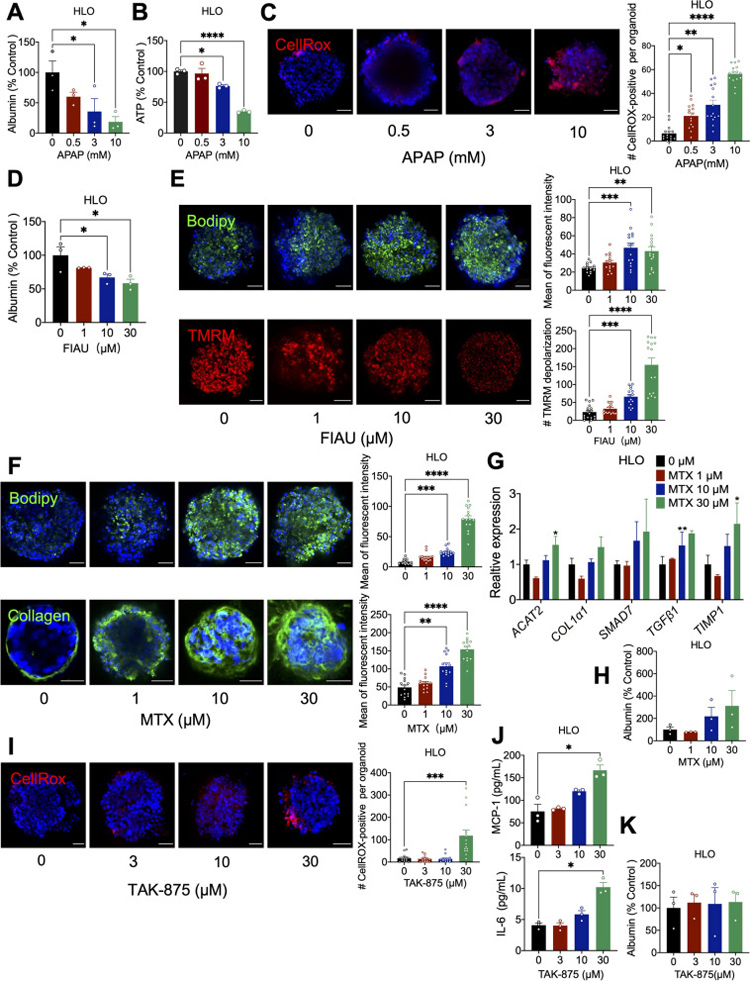
原文图2 使用药物处理后的HLOs进行表型分析
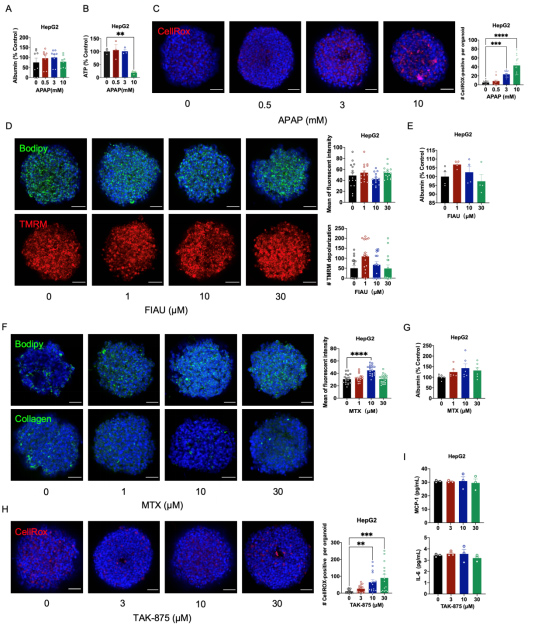
补充图1 使用药物处理后的HepG2球状体进行表型分析
非阿尿苷(FIAU)是一种抗病毒核苷类似物,在人体中会引起特定的肝脏脂肪变性和严重的肝损伤[6]。在FIAU处理后,HLOs的白蛋白分泌呈剂量依赖性下降,表明药物诱导的肝细胞损伤。Bodipy染色显示明显的脂质积累,表明FIAU治疗诱发的肝脂肪变性。此外,线粒体膜电位敏感染料TMRM的密度降低也表明线粒体膜明显去极化,这可能是FIAU诱导脂肪变性的原因之一。
氨甲蝶呤(MTX)是另一种已被发现会导致人类肝脏损伤的药物,可引起脂肪变性、纤维化甚至肝硬化[7]。MTX处理7天的HLO会出现显著的脂质积累和纤维化,由于HepG2球状体不含肝星状细胞,所以MTX处理后在HepG2细胞中未检测到胶原I信号。
特异质性DILI(I-DILI)是一种罕见疾病,是临床上难以预测的肝毒性形式之一。一般认为,I-DILI是由药物或活性代谢物的内在化学反应性引起的。TAK-875是一种G蛋白偶联受体40(GPR40)激动剂,30 μM TAK-875处理HLO1周后,发现ROS形成增加,同时炎性细胞因子单核细胞趋化蛋白-1(MCP-1)和白细胞介素6(IL-6)的释放也显著增加。
治疗后未发现HLOs白蛋白分泌异常。这些结果表明,TAK-875处理的HLO在氧化应激和免疫反应中具有可检测到的毒性。HepG2球状体经TAK-875处理后也显示出ROS的积累,但未发现炎性细胞因子的影响,这可能是由于缺乏免疫细胞的缘故。
3、基于HLOs高内涵分析预测抗肝纤维化药物疗效
通过上述实验设置,作者已经证明HLO能够模拟不同药物诱导的多种毒性表型,如脂肪肝变性、纤维化、线粒体功能障碍、氧化应激和免疫反应。接下来,作者希望利用HLO建立一个高通量平台,进行抗肝纤维化药物筛选。转化生长因子β(TGFβ)和脂多糖(LPS)是众所周知的常见致病因子,可诱发多种肝纤维化。
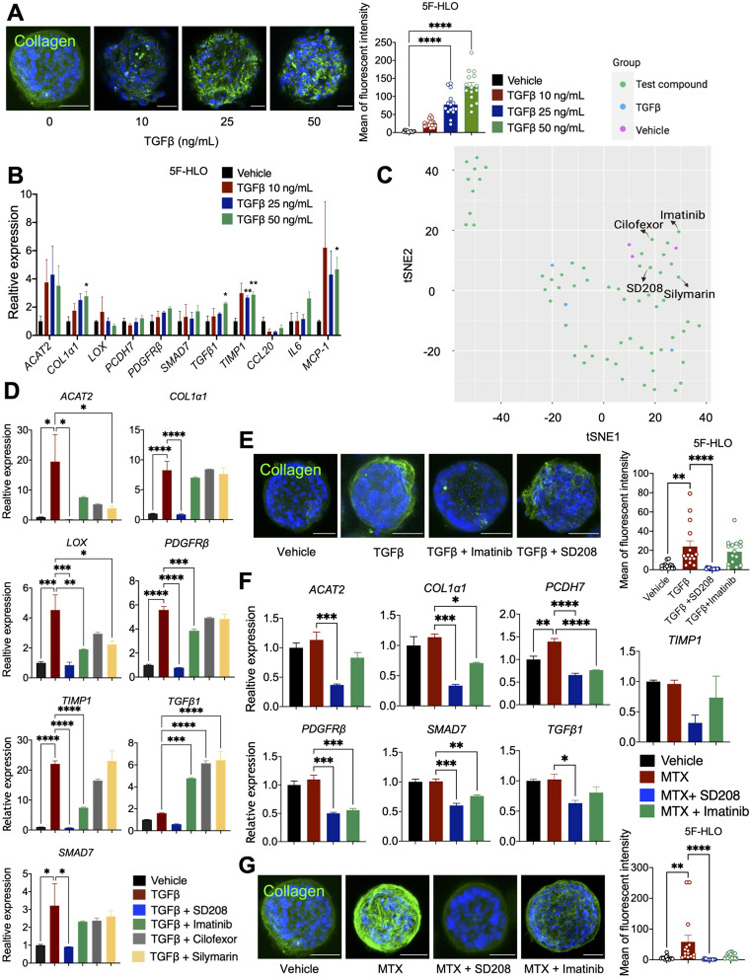
原文图3 使用HLO基于高内涵分析预测抗肝纤维化药物疗效
在用50 ng/mL的TGFβ或200 ng/mL的LPS处理后,在胶原I染色中观察到大量碎裂,这可能是由于细胞死亡所致。因此,作者采用25 ng/mL的TGFβ处理作为纤维化模型,用于后期筛选。
然后,建立高内涵分析,提取并量化三种类型的类器官中与类器官形状、胶原分布和荧光强度相关的共16个特征,以评估抗纤维化效果,然后进行了T分布随机邻接嵌入(tSNE)分析,以确定化合物之间的主要聚类。这表明这些化合物可能具有抗纤维化作用,其中SD208是一种已确定的TGFβ抑制剂。对MTX诱导和LPS诱导的肝纤维化HLO模型的进一步分析也表明,SD208在MTX和LPS诱导的肝纤维化中具有潜在的抗纤维化作用,伊马替尼在MTX诱导的肝纤维化中具有潜在的抗纤维化作用。
03、编者点评
作者证明了HLO在培养皿中模拟DILI和高通量抗纤维化化合物筛选中的效用。然而,尽管HLO对诱导纤维化或免疫应答的药物有功能反应,表明HLOs中存在功能性星状细胞和免疫细胞,但作者在本研究中并未对HLOs中各细胞类型的组成和功能进行仔细研究。综上所述,人诱导多能干细胞诱导的HLO保留了肝脏组织的特征,可推进类器官的基础研究,促进药物研发及疾病建模相关研究的发展!
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特类器官平台已建立人诱导多能干细胞及多种癌种的类器官培养平台,欢迎有需要的读者垂询!
参考文献
[1] Hammer H, Schmidt F, Marx-Stoelting P, Potz O, Braeuning A. Cross-species analysis of hepatic cytochrome P450 and transport protein expression. Arch Toxicol. 2021;95:117–133.
[2] Mosedale M, Cai Y, Eaddy JS, Kirby PJ, Wolenski FS, Dragan Y, et al. Human-relevant mechanisms and risk factors for TAK-875-induced liver injury identified via a gene pathway-based approach in collaborative cross mice. Toxicology. 2021;461:152902.
[3] Ouchi R, Togo S, Kimura M, Shinozawa T, Koido M, Koike H, et al. Modeling steatohepatitis in humans with pluripotent stem cell-derived organoids. Cell Metab. 2019;30(374–84).
[4] Shinozawa T, Kimura M, Cai Y, Saiki N, Yoneyama Y, Ouchi R, et al. High-fidelity drug-induced liver injury screen using human pluripotent stem cell-derived organoids. Gastroenterology. 2021;160(831–46).
[5] Ramirez T, Strigun A, Verlohner A, Huener HA, Peter E, Herold M, et al. Prediction of liver toxicity and mode of action using metabolomics in vitro in HepG2 cells. Arch Toxicol. 2018;92:893–906.
[6] Jolly CE, Douglas O, Kamalian L, Jenkins RE, Beckett AJ, Penman SL, et al. The utility of a differentiated preclinical liver model, HepaRG cells, in investigating delayed toxicity via inhibition of mitochondrial-replication induced by fialuridine. Toxicol Appl Pharmacol. 2020;403:115163.
7] Bath RK, Brar NK, Forouhar FA, Wu GY. A review of methotrexate-associated hepatotoxicity. J Dig Dis. 2014;15:517–524