业务咨询

![]() 发布时间:2024-04-12
发布时间:2024-04-12
![]() 环特生物
环特生物
![]() 浏览次数:3077
浏览次数:3077
4月11日是世界帕金森病日。数据显示,全球范围内帕金森病患者约为1000万,我国现有帕金森病患者300万人,且每年新发20万例以上。一提起它,人们对它的印象是“抖”。帕金森氏病 (Parkinson's Disease, PD), 作为目前仅次于阿尔茨海默(alzheimer's disease,AD)的第二大神经系统退行性疾病,其临床特征表现为神经系统中神经细胞的传递丢失,表现出静止性震颤、肌强直、运动迟缓以及姿势平衡障碍等症状。然而,其病因尚不清楚。
斑马鱼因其与人类基因高度相似、胚胎透明、体积小、对化合物的渗透性高及对环境变化的敏感性等特点,能观察到DA长投射纤维在脑和脊髓的分布,模拟帕金森病的发生和发展过程,成为帕金森病研究的理想模型,对更好地理解帕金森病的发病机制、筛选出有效的治疗方法等有着重要的作用,并呈现出巨大的应用潜力。
01、斑马鱼在帕金森病中的研究方向
当前,斑马鱼在帕金森病研究中的应用日益广泛,其研究方向主要集中在疾病模型构建、发病机制探究、药物筛选与治疗策略评估等。具体包括:
用于帕金森病模型的建立
斑马鱼的神经系统与人类有很高的相似性,其神经递质系统,包括胆碱能、多巴胺能、去甲肾上腺素能通路已经被阐明,而且其基因表达、细胞信号传导等过程也与人类相近。
通过构建帕金森化学诱导模型、帕金森遗传模型等,模拟帕金森病的关键病理特征,如多巴胺能神经元的损伤和丧失,研究者能够在斑马鱼中重现帕金森病的某些表型,观察帕金森病相关基因的表达变化,不仅有助于精准模拟帕金森病的病理表现,研究神经元损伤和修复的分子机制,从而进一步揭示帕金森病的发病机理,还能为后续的药物发现、药物治疗和疾病干预提供有力的模型基础。
用于帕金森病药物筛选与评估
由于斑马鱼具有高通量、高敏感度等特点,且斑马鱼多巴胺能系统的组织和功能与哺乳脊椎动物相比更加稳定,因此,斑马鱼是用于测试神经活性化合物作用的理想动物模型。
研究者可以利用斑马鱼模型对大量潜在的帕金森药物进行筛选,快速找出可能对帕金森病有治疗效果的药物,不仅大大提高了药物筛选的效率,评估药物对罕见病的治疗效果及药物的副作用、安全性等,还能降低药物研发的成本和风险。
用于评估帕金森病的治疗策略
通过斑马鱼基因编辑等技术,研究者可以构建具有特定基因突变的斑马鱼PD模型,以模拟人类PD患者的遗传背景,有助于进行不同的帕金森病治疗干预,观察治疗效果,并评估不同治疗策略的优劣,为帕金森病的临床治疗提供了新的思路和方法。
用于PD关联毒素及发病机制研究
通过观察斑马鱼在PD关联毒素作用下的反应,研究者可以深入了解PD的发病机制和毒素对神经系统的影响。
研究表明,接触环境中的一些毒素时,会增加患PD风险,因此,斑马鱼模型被用来研究与PD关联的毒素及其发病机制。常见的环境毒素如鱼藤酮 (Rotenone)、百草枯 (Paraquat)、齐拉姆 (Ziram) 及苯菌灵 (Benomyl) 都会不同程度地影响斑马鱼模型的多巴胺神经系统并产生行动影响,因而这些毒素都被证实了会增加患PD的风险。也有研究显示,经柴油废气颗粒提取物 (DEPe) 处理的斑马鱼胚胎也出现了多种神经元的丧失 (包括多巴胺神经元) 及行为改变,从而导致PD发病。
02、斑马鱼在帕金森病中的应用进展
近年来,作为一种新兴的研究工具,斑马鱼在帕金森病(PD)研究中的应用取得了显著的进展,对神经系统退行性疾病的治疗产生了重大意义,也为开发有效的帕金森病治疗方法提供了有力的支持。
从斑马鱼获得治疗帕金森的方法
与哺乳动物相比,成年斑马鱼会使大脑中的神经元再生,但这种能力的程度和变异性尚不清楚。来自Edinburgh大学脑神经科学研究中心的Thomas Becker及其研究团队探寻了各种多巴胺能神经元群体的丧失是否足以触发神经元的功能性再生。他们的研究结果为未来治疗具有运动异常、震颤等症状的神经系统疾病提供了新的思路。
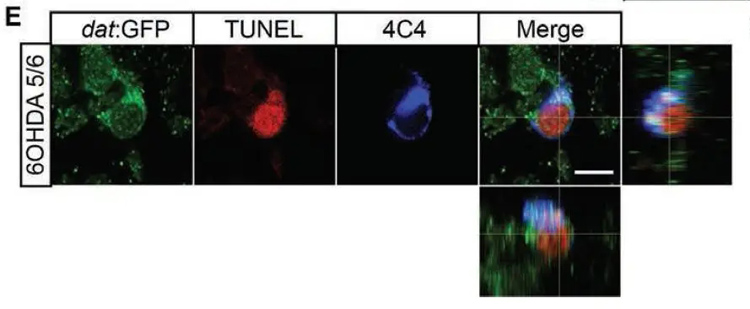
研究人员分析了斑马鱼两种性别的遗传谱系,其示踪显示特定的间脑室间室 - 放射状神经胶质祖细胞(ERG)产生新的多巴胺能(Th +)神经元。消融引发的免疫应答可增加ERG的增殖并促进Th +神经元的产生。抑制免疫应答会使神经再生减弱至对照水平。促进免疫反应增强ERG增殖,但不增加Th +神经元。因此,成年斑马鱼脑中的多巴胺能神经元显示出与神经元组成相关的再生能力差异,且这一功能再生依赖于免疫系统激活。
来源:Catherina G. Becker, Thomas Becker. Regeneration of dopaminergic neurons in adult zebrafish depends on immune system activation and differs for distinct populations
斑马鱼模型揭开帕金森氏疾病的“面纱”
近年来,许多研究利用斑马鱼动物模型来观测α-syn的扩散及预测PD病情发展,来自加州大学洛杉矶分校戴维·格芬医学院的Lisa M. Barnhill教授团队在Biomedicines期刊上发表综述回顾了基于斑马鱼模型的PD病理生理学新发现,总结了PD发病机制规律及开发斑马鱼模型的方法,为未来的PD病理生理学研究及其治疗方法提供了启示。
综述中介绍了Synuclein、LRRK2、GBA、Parkin、DJ1和 (PTEN)-Induced Putative Kinase1(Pink1) 的编码基因是几种常见的用于构建PD斑马鱼模型的基因修饰位点。值得注意的是,斑马鱼体内的这些基因与人的基因有着很高的同源性 (大多高于65%)。Synuclein、LRRK2、GBA、Parkin基因敲除的研究都表明PD的发病与α-syn聚集有关,敲除Pink1的模型阐述了PD与线粒体功能异常的相关性,DJ1模型则表现出了星形胶质细胞的过度表达对PD发病风险的提升。
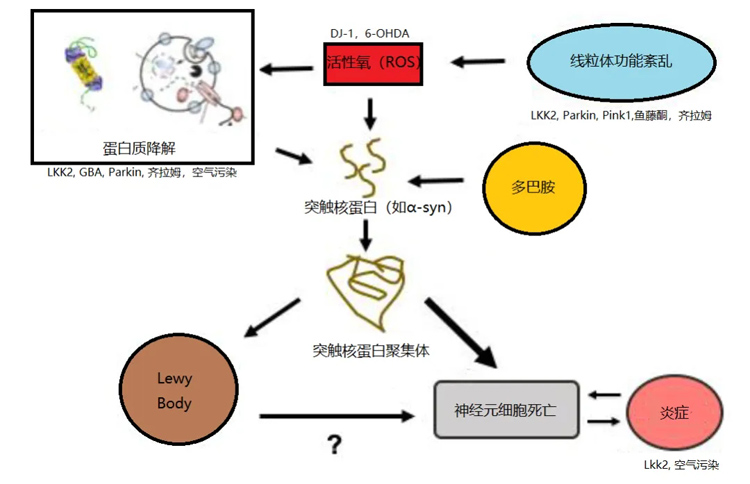
图. PD发病的病理机制总结
探究三种抗帕金森症化合物的作用
目前,尽管大量新的抗帕金森的候选药物在临床前研究中取得初步成功,但对开发新的替代药物的需求依旧不断增长。
斑马鱼因为体积小、透明度高、对化合物的渗透性高,特别适合大规模药物筛选。当斑马鱼幼鱼被6-OHDA (6-羟基多巴胺) 影响后,会展现出典型的帕金森症表型特征,即多巴胺能神经元的死亡和运动迟缓。此外,6-OHDA 损伤的斑马鱼对抗帕金森病化合物有反应,因此斑马鱼模型是极好的评估新疗法的工具。
为缓解6-OHDA损伤的斑马鱼幼鱼的运动障碍以及神经细胞数量减少的症状,本次实验主要探究三种抗帕金森症的化合物L-dopa, rasagiline 和 isradipine的作用。研究人员最终选用了stavudine, tapentadol 和 nabumetone作为帕金森症的靶向药。
研究结果表明,L-dopa, rasagiline and isradipine可缓解斑马鱼幼鱼运动迟缓;Isradipine可以缓解多巴胺能细胞数量的减少;Isradipine和amantadine可以减少幼鱼的运动障碍样行为;
通过基于表型的筛选来识别具有抗帕金森病潜能的化合物,最终确定了三种:stavudine, tapentadol 和nabumetone,作为最有效的可以用于未来研究抗帕金森靶向药的药品(Table1)。
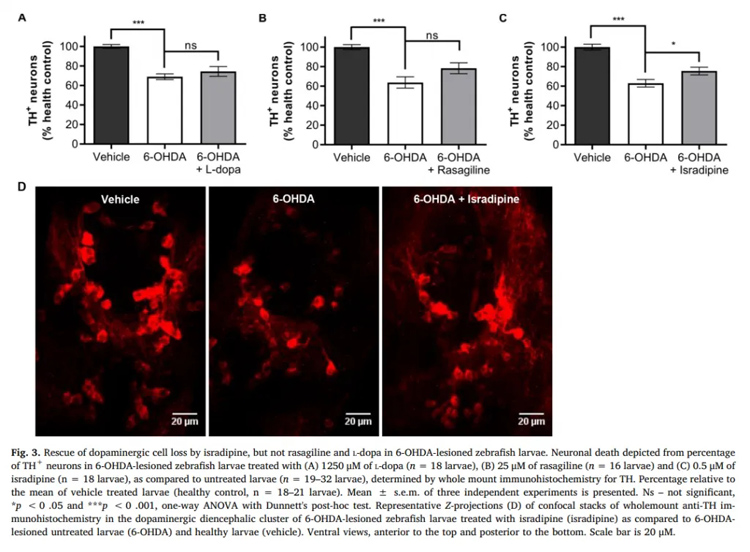
来源:Vaz, Rita L., et al. “Identification of Antiparkinsonian Drugs in the 6-Hydroxydopamine Zebrafish Model.” Pharmacology Biochemistry and Behavior, vol. 189, 2020, p. 172828.
YIAEDAER肽对斑马鱼帕金森病样病理的神经保护作用
当前,在探索新的疾病修饰治疗策略的过程中,天然来源的化合物引起了人们的广泛关注。八肽是一种从香螺内脏块提取物中分离纯化的多功能肽,其对MPTP(1-甲基-4-苯基-1,2,3,6-四氢吡啶)诱导的PD模型的神经保护作用尚未报道。多巴胺能神经元细胞缺失或多巴胺变性及α-syn存在的水平高低,作为PD的一个重要特征及神经病理标志的主要成分,它们的变化能直接说明PD的治疗效果。
近期,国际期刊Biomedicine & Pharmacotherapy发表论文《YIAEDAER肽对斑马鱼帕金森病样病理的神经保护作用》,揭示了YIAEDAER (tyrl-ile-ala-glu-asp-ala-glu-arg)肽可能是一种很有潜力的治疗MPTP诱导的PD疾病的候选药物,为开发并克服目前PD治疗局限性的问题,给出新的治疗策略及思路。
图. YIAEDAER肽结构
来源:Qingyu Ren, Neuroprotective effect of YIAEDAER peptide against Parkinson’s disease like pathology in zebrafish,Biomedicine & Pharmacotherapy 147 (2022) 112629
单细胞转录组学揭示锰对斑马鱼大脑神经发生的毒性机制
锰(Mn)被视为引发帕金森病的环境风险因子,锰过量接触会严重损害各类神经细胞,进而影响神经系统的正常发育,导致神经功能出现障碍。2023年11月10日,首都医科大学公共卫生学院劳动卫生与环境卫生学系牛丕业教授团队在Environmental Pollution(IF:8.9)上发表了题为“Single-cell transcriptomics analysis of zebrafish brain reveals adverse effects of manganese on neurogenesis”的文章,该研究揭示了锰对斑马鱼大脑神经发生的毒性机制。
本研究利用单细胞RNA测序分析了锰对斑马鱼大脑神经发生的毒性作用机理,发现低浓度的锰暴露会激活斑马鱼大脑的神经发生,包括促进神经祖细胞的增殖以及分化为新生神经元和少突胶质细胞,而高浓度的锰暴露则会抑制神经发生和神经功能;并且锰暴露可通过特定的分子途径影响神经发生。此外,锰还能调节细胞间的通讯,并通过特定的信号通路影响神经细胞间的通讯。总之,该研究阐明了斑马鱼大脑的细胞组成,并加深了对锰诱导神经发生损伤机制的理解。欧易生物提供了该项目的单细胞转录组测序工作。
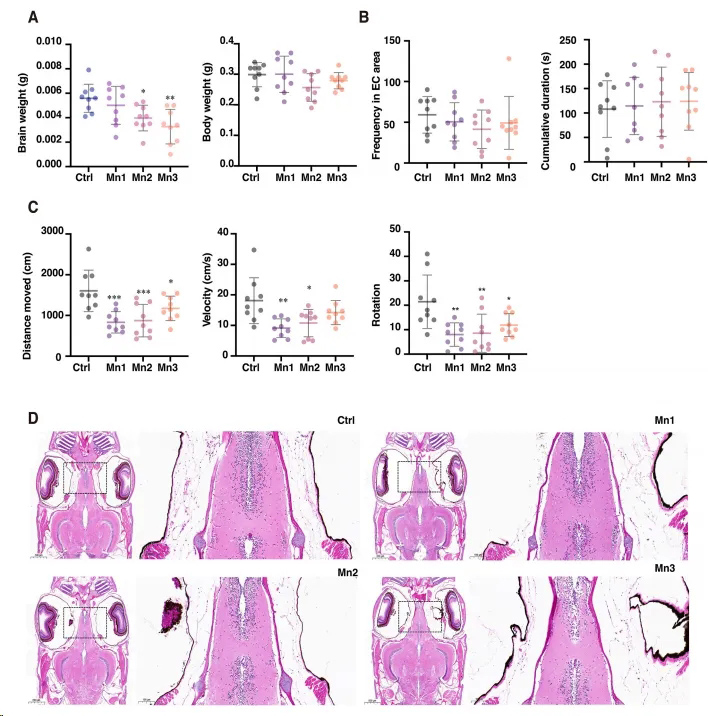
图. 斑马鱼的运动能力和神经受锰暴露的影响
你我同行,不再惧“帕”!近年来,斑马鱼+基因编辑技术的发展,为帕金森病等的治疗、药物研发及机制研究等提供了新的可能性。环特生物依托于斑马鱼+哺乳动物+类器官+基因编辑4大技术平台,基于过去10余年持续的技术创新实践,以专业、前沿的技术服务解决方案,助力科研人员在帕金森病研究与治疗上取得更多突破,共同探索更多未知中的微光,点亮生命之光!
业务合作咨询:成先生 173 6453 1293(微信同号)
