业务咨询

![]() 发布时间:2024-07-15
发布时间:2024-07-15
![]() 环特生物
环特生物
![]() 浏览次数:3225
浏览次数:3225
编者按
当前,胃癌(GC)是全球第五大常见癌症、第四大癌症死亡原因,其发病率在过去几十年呈上升趋势。手术切除联合围手术期化疗是局部晚期胃癌患者的一线治疗选择。然而,胃癌(GC)患者化疗的疗效差异显著,目前尚缺少有效的策略来预测化疗结果。
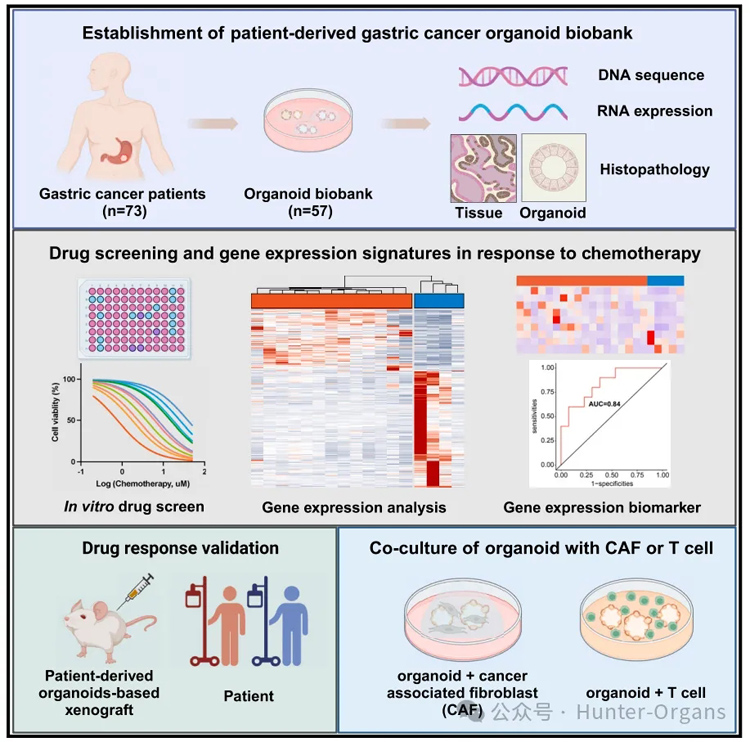
2024年7月3日,中山大学研究员李晓星、中山大学/香港中文大学于君教授、中山大学副研究员许丽霞等在Cell Reports Medicine上发表题为“Personalized drug screening using patient-derived organoid and its clinical relevance in gastric cancer”的最新研究成果,该研究从73名胃癌(GC)患者中成功构建了57个胃癌患者来源的类器官(PDOs),这些类器官保留了其肿瘤结构与功能特征,可用于预测患者对化疗药物的治疗反应。因此,评估胃癌类器官的化疗敏感性可以作为筛选胃癌患者个性化选择化疗药物的有力工具。
文章题目
Personalized drug screening using patient-derived organoid and its clinical relevance in gastric cancer
杂志:Cell Reports Medicine(IF=14.3)
发表时间:2024.7.3
作者:于君、许丽霞、李晓星等
单位:中山大学
01、研究亮点
• 构建胃癌(GC)类器官生物样本库;
• 识别鉴定与化疗药物敏感性、耐药性相关的基因表达特征;
• 利用胃癌类器官,在体外、体内再现胃癌患者的化疗药物反应;
• 胃癌类器官可与T细胞及肿瘤相关的成纤维细胞进行共培养。
02、研究背景
胃癌(GC)是全球第五大常见癌症、第四大癌症死亡原因,其发病率在过去几十年呈上升趋势。手术切除联合围手术期化疗是局部晚期胃癌患者的一线治疗选择。最常见的常规化疗药物包括氟尿嘧啶(如5-氟尿嘧啶[5-FU]、卡培他滨和替吉奥)和铂类化合物(如顺铂和奥沙利铂)。然而,胃癌患者对这些化疗药物的反应差异很大,且原因尚不明确。因此,为提高胃癌患者的化疗疗效和临床结果,亟需开发能够准确预测胃癌患者化疗疗效的方法。
类器官培养物是三维细胞聚集体。最近的研究表明,患者来源的类器官(PDOs)可以预测患者的治疗反应,尤其是PDOs,能够准确地保留并再现其原始肿瘤的遗传特性和组织病理学特征,这表明它们在个性化肿瘤治疗中的潜在应用。三个独立的研究小组报告了胃癌患者来源的PDOs的构建情况,并探讨了PDOs在预测药物反应中的应用。然而,这些研究缺乏对化疗敏感性相关基因表达特征的探讨。来自类器官或原始肿瘤组织的的基因特征有助于识别治疗反应的预测性生物标志物。因此,基于PDOs的基因表达和化疗敏感性的综合分析非常重要。
以往对胃癌患者来源的类器官(PDOs)进行药物筛选的研究样本量相对较小。通过对大量胃癌患者来源的类器官(PDOs)进行药物筛选,对于为GC患者提供准确可靠的个性化治疗预测是必要的。
在此,研究人员报告了胃癌患者来源的类器官生物库的建立,并模拟人类胃癌的组织学特征及对不同化疗药物的不同反应。通过RNA测序,在5-氟尿嘧啶(FU)或奥沙利铂敏感的类器官中发现了肿瘤抑制基因/途径的上调,而在化疗耐药的类器官中,与增殖和侵袭相关的基因/途径则丰富。鉴定出能够区分5-FU和奥沙利铂敏感和耐药患者(剂量反应曲线下面积[AUC] >0.8)的基因表达生物标志物面板。
此外,PDOs的药物反应结果在患者源性类器官异种移植(PDOX)小鼠中得到了验证,与91.7% (11/12)GC患者的实际临床反应一致。评估PDOs的化疗敏感性可以作为筛选GC患者化疗药物的有价值的工具。
03、研究结果
1. 建立患者来源的胃癌类器官生物库
研究人员从73例经组织学诊断为胃腺癌的患者手术切除标本中获取胃肿瘤组织,建立了57个患者来源的胃癌类器官生物库,成功率为78%(57/73)(图1A)。具体而言,53个类器官来源于未经治疗的患者,4个类器官来源于接受新辅助化疗的患者(图1B)。这些胃癌类器官来自胃的不同部位,如贲门、胃底、胃体、胃窦和胃角等,并涵盖了不同的肿瘤-结节-转移(TNM)分期阶段,包括I期、II期、III期和IV期(图1B)。
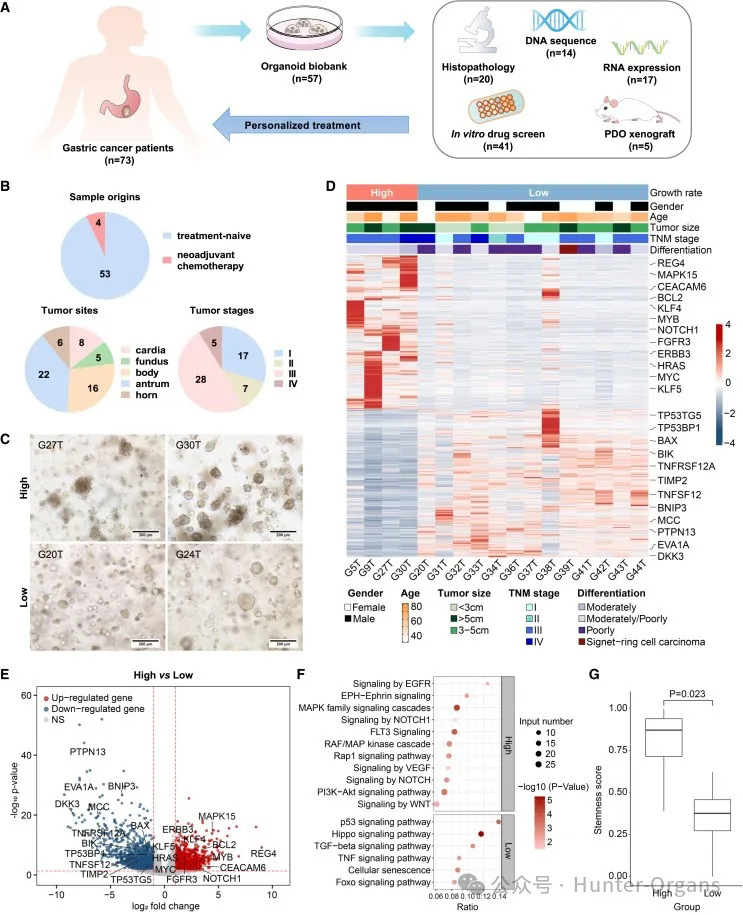
图1
不同的胃癌类器官具有不同的生长率。高生长率类器官表现出增殖性祖细胞表型,并形成了无腔球状、囊样形态,可连续传代多达17代,且增殖能力未出现明显减弱,如G5T、G9T、G27T、G30T和G72T)(图1C);而低生长速率类器官具有腺体形态,出现管腔,8-9代后就无法进一步传代(图1C)。因此,实验结果表明已成功建立患者来源的胃癌类器官(Patient-Derived Organoids, PDOs)生物库,这些类器官具有不同的生长特征,如高生长率或低生长率。
2. 阐明高生长率或低生长率类器官的基因表达谱
RNA测序结果显示,高生长率与低生长率胃癌类器官之间存在显著的基因表达差异(图1D)。高生长率类器官中,增殖和干性相关基因,如REG4、KLF4、ERBB3、HRAS、NOTCH1和MYC等显著上调(图1E),而低生长率类器官中,抑制细胞生长的基因,如BAX、DKK3、TNFSF12、MCC、BNIP3和TP53BP1,则呈现下调趋势(图1D和1E)。
进一步进行KEGG通路分析证实,高生长率类器官中增殖和干性相关通路显著上调,如MAPK家族信号级联反应和NOTCH信号,均能促进细胞增殖并维持干细胞功能(图1F)。与低生长率类器官相比,高生长率类器官中细胞分化和凋亡相关通路均相对下调,如Hippo信号通路和p53信号通路(图1F)。
此外,研究人员分析发现类器官生长率(高生长率与低生长率)与临床病理特征之间无显著相关性(表S2)。通过全外显子组测序显示,高生长率与低生长率类器官在基因突变方面无显著差异,包括TP53、CDH1、ARID1A、MUC6和RNF43等已知的驱动突变(图S1)。因此,高生长率与低生长率类器官具有不同的基因表达模式,高生长率类器官表现出更强的增殖与干细胞特性,也一定程度上解释了它们在生长特征上的差异。
3. 胃癌类器官及其对应肿瘤组织的基因表达分析
随后,研究人员探究了类器官培养中如何维持稳定的肿瘤特异性基因表达。通过RNA测序结果发现,类器官与其对应的原发肿瘤组织在基因表达模式上具有高度的相似性(图2A和2B)。通过定量分析比较RNA测序的替代转录本水平的基因表达,结果显示,匹配的类器官与原发肿瘤在基因表达上呈现出高度的一致性(图S2A)。
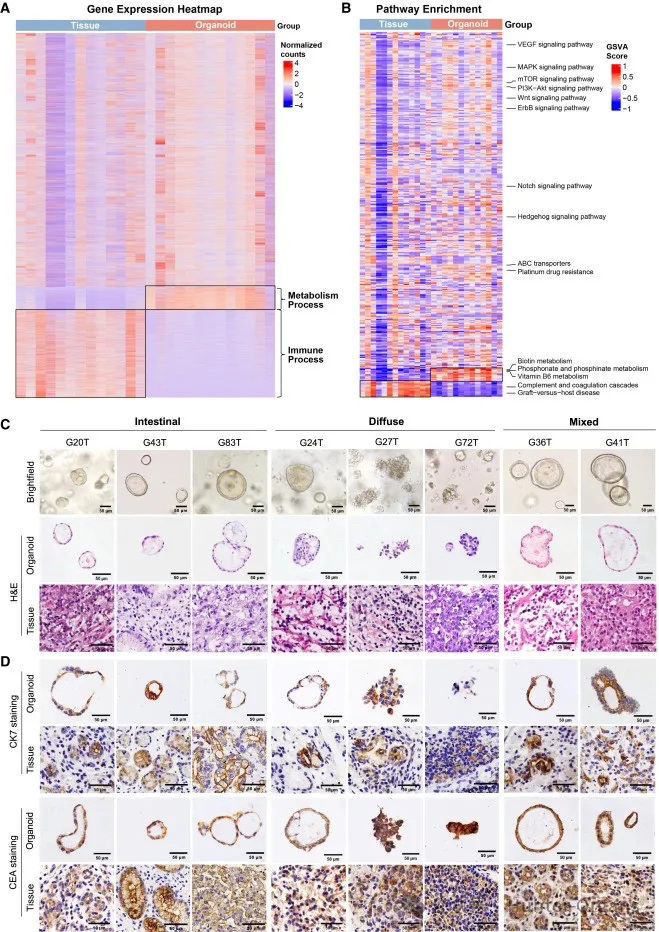
图2
4. 胃癌类器官保留了原发胃癌的组织病理学特征
研究人员评估了胃癌类器官能否保留其来源的肿瘤组织学特征和蛋白质表达。结果显示,胃癌类器官保留了其对应的原发肿瘤特定腺体特征,包括腺体、离散性或实性生长模式及核分层(图2C和S2B)。
此外,这些类器官还表现出与其对应的原发肿瘤亚型相似的组织学特征,如弥漫型、肠型和混合型胃癌等。其中,源自肠型肿瘤(G20T和G43T)的胃癌类器官呈现出由单个上皮层或筛状腺体形态构成的大球体,细胞形成多个大小不一的腔隙;源自弥漫型肿瘤(G27T和G72T)的胃癌类器官,形成松散的实性细胞簇或囊性结构(G24T和G39T);而源自混合型胃癌(G36T和G41T)的胃癌类器官,则表现出弥漫型和肠型肿瘤的混合组织学模式(图2C和S2B)。
为了进一步确认胃癌类器官保留了其来源肿瘤的特性,研究人员对胃癌标志物细胞角蛋白7(CK7)和癌胚抗原(CEA)的蛋白表达进行了免疫组织化学分析。如图2D、S2C所示,胃癌类器官与对应的原发肿瘤中的蛋白质标记物的存在和强度相似;CK7和CEA强度的Allred评分高度相关(图S2D)。鉴于肿瘤组织的异质性,研究人员还检查了表达强度不一致的病例,并发现CK7(在G43T和G56T中)和CEA(在G62T和G56T中)在原发肿瘤和类器官之间的表达强度存在差异(图S2D)。
这些结果表明,胃癌类器官保留了其原发肿瘤的组织病理学特征,因此,患者来源的胃癌类器官(GC PDOs)可以在药物测试中有效模拟个体患者的原发胃癌。
5. 患者来源的胃癌类器官对化疗药物的筛选
为了探索胃癌类器官对不同药物的反应,研究人员选择了6种常规化疗药物(5-氟尿嘧啶(5-FU)、奥沙利铂、顺铂、紫杉醇、多柔比星和SN-38)对41种胃癌类器官进行了测试,每种药物在5个不同浓度下进行三次重复筛选。为了评估每种类器官对不同浓度药物的反应情况,对每个类器官系的两个不同传代均在不同浓度下进行处理。结果发现,同一类器官系两个传代的生物重复样本的剂量-反应曲线(DRC)下面积(AUC)值高度相关,表明培养系统是稳定的,不受外部条件及类器官传代差异的影响(图3A和S3A)。
为了确保半数抑制浓度(IC50)估计的准确性,研究人员使用了额外的浓度系统来测试药物的敏感性。分析表明,同一类器官系的两组药物浓度(十浓度和五浓度)的AUC值和IC50值具有高度的相关性(图S3B和S3C);不同胃癌患者的类器官对化疗药物的反应各不相同(图3B;表S3)。一些类器官对5-氟尿嘧啶(5-FU)、奥沙利铂、顺铂、紫杉醇、SN-38和多柔比星等具有耐药性,而有的则表现出部分敏感或敏感(图3C),如弥漫型胃癌生成的类器官更可能对5-FU和紫杉醇敏感(图3C)。
这些结果表明,患者来源的胃癌类器官是药物筛选的潜在有效工具,对不同常规化疗药物的反应各不相同。
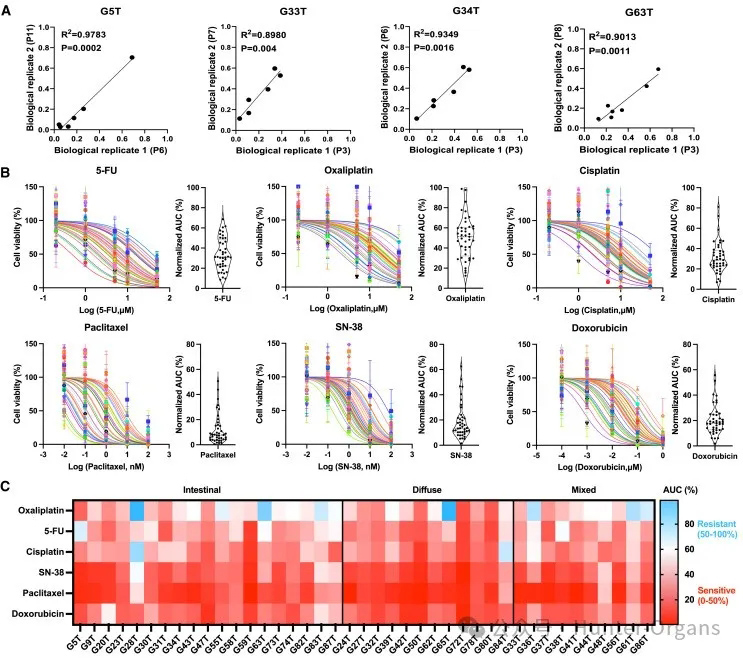
图3
6. 患者来源的胃癌类器官对化疗药物的基因表达特征分析
为了评估胃癌患者对5-氟尿嘧啶(5-FU)或奥沙利铂这两种最常用的化疗药物的反应,研究人员通过转录组测序分析了17个PDOs的基因表达特征。
基于这些胃癌类器官对5-FU和奥沙利铂的反应,将其分为敏感组和耐药组(敏感:AUC < 50%;耐药:AUC ≥ 50%)。通过比较敏感组与耐药组的基因表达谱,发现在5-FU敏感组(n = 13)和耐药组(n = 4)的胃癌类器官中基因表达存在显著差异(图4A)。与5-FU耐药组相比,敏感组中的肿瘤抑制基因显著上调,包括MSMB、S1PR4、PURPL、TP53INP1和TRIM16等(图4B)。
KOBAS分析表明,5-FU敏感类器官中,肿瘤抑制性p53信号通路和细胞凋亡显著上调(图4C),而与增殖和侵袭相关的基因在敏感组中显著下降,如FKBP10、DARPP32、ASCL2、BCL2、ABCC2和NOTCH1(图4A和4B)。这些基因富集于肿瘤侵袭和干细胞相关的通路中,包括NOTCH信号通路、WNT信号通路、Rho GTP酶信号通路和细胞外基质组织(图4C)。
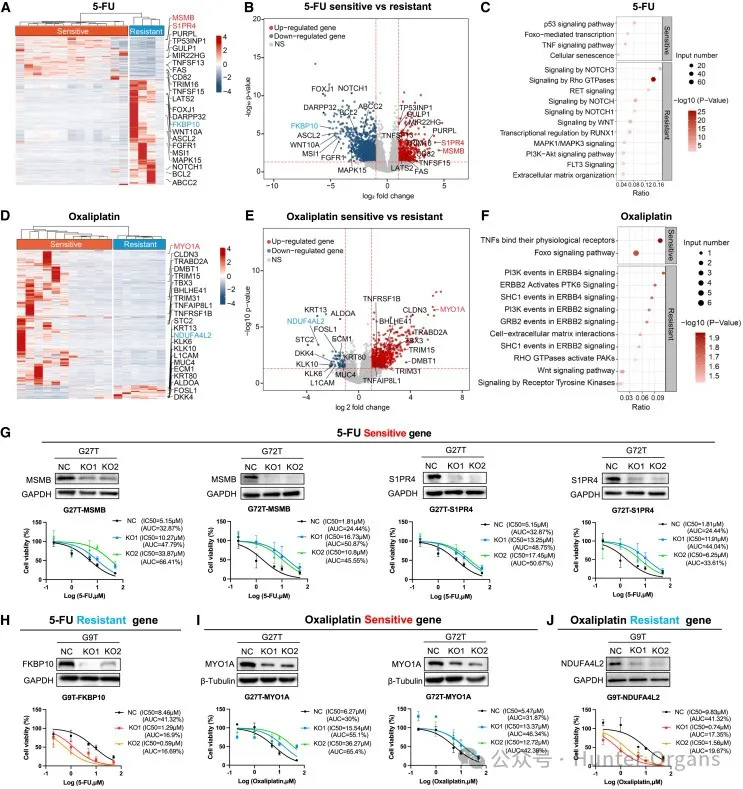
图4
在对11个奥沙利铂敏感的胃癌类器官和6个耐药的胃癌类器官中也观察到了基因表达的显著差异(图4D)。与耐药组相比,奥沙利铂敏感组类器官中肿瘤抑制相关基因显著上调,包括MYO1A、CLDN3、DMBT1、TNFRSF1B和TRIM15(图4E)。这些上调的基因主要富集在肿瘤抑制途径中,特别是肿瘤坏死因子(TNF)信号和FOXO信号(图4F),而在敏感组中,与增殖和侵袭相关的基因显著下降,包括NDUFA4L2、DKK4、KLK10、FOSL1、STC2和L1CAM(图4E),这些基因涉及PI3K信号和WNT信号增殖途径(图4F)。综上所述,我们揭示了胃癌类器官对化疗药物的基因表达特征。
此外,研究人员还在胃癌类器官中敲除RNA测序鉴定的敏感或耐药基因以进行,证实了这些基因在类器官中对5-FU和奥沙利铂治疗反应的功能影响。
7. 胃癌类器官对化疗药物反应的基因突变特征
为了研究类器官对化疗药物的突变谱,研究人员通过全外显子组测序发现,在基因突变方面,5-FU敏感型与耐药型类器官没有显著差异,包括胃癌中常见的ARID1A、TP53、KRAS、CDH1和PIK3CA突变(图S4A)。然而,与耐药组相比,奥沙利铂敏感组突变更多,其中,MUC6、ARID1A和RIMS2突变频率最高(图S4B)。
8. 胃癌患者化疗基因表达生物标志物的鉴定
接着,研究人员通过递归特征消除算法研究了肿瘤组织的基因表达生物标志物,这9个具有显著差异表达的基因能够区分5-FU治疗的敏感患者和耐药患者,包括6个上调基因(RNASEH2A、MMP3、CXCL1、COL5A2、MXRA5和PTTG1)和3个下降基因(SLC2A1、RRAD和APLP1)。与5-FU耐药患者的肿瘤组织相比,它们具有显著差异(图5A)。
接着,通过逻辑回归模型和朴素贝叶斯模型对这些生物标志物的准确性和有效性进行了验证。与耐药组相比,奥沙利铂敏感组的肿瘤组织中鉴定出6个差异表达基因,包括3个上调基因(TNFSF9、WNT2和EGR3)和3个下调基因(MT2A、SULT2B1和ALDOB)(图5C)。这些发现表明,该基因表达生物标志物组能够区分对5-FU和奥沙利铂化疗敏感的患者与耐药患者。
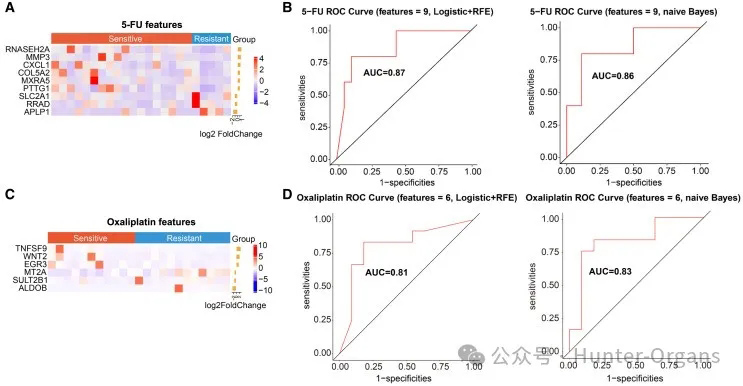
图5
此外,在另一组队列(癌症基因组图谱[TCGA])中验证了这一基因特征,并分析了其与生存曲线的相关性。生存分析显示,在5-FU治疗组(n=68)中,敏感组的患者无进展生存期预后更好(p<0.05)(图S5A),但无法在两组患者的预后中识别出显著差异(图S5B),逻辑回归和朴素贝叶斯模型也证实了研究中这些组的有效性(图S6A和S6B)。
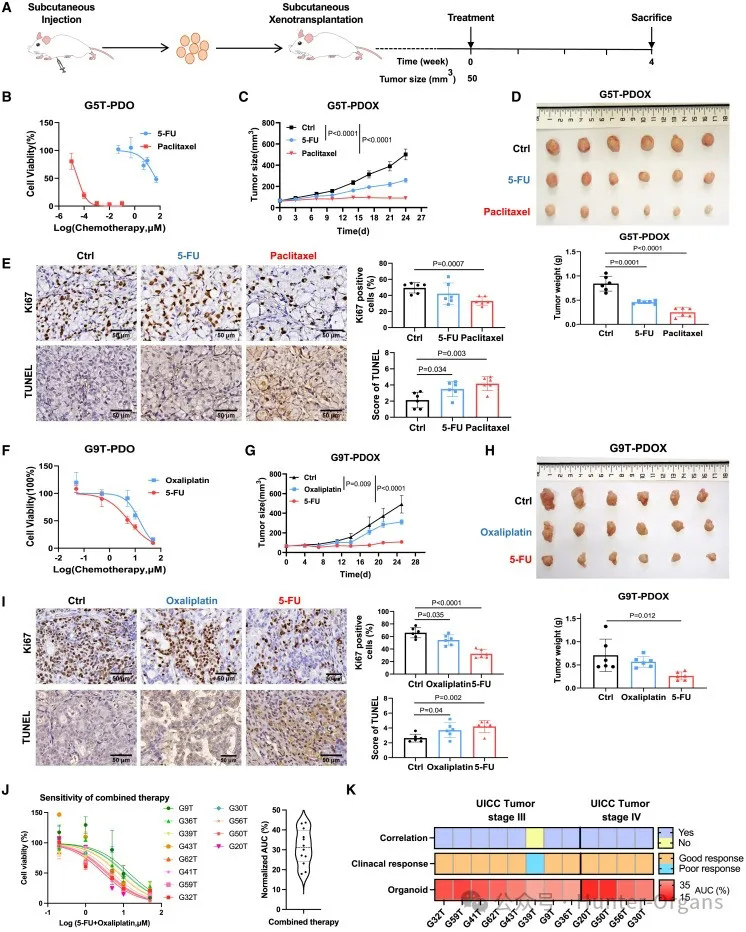
图6
9. 在小鼠PDOX模型中验证GC PDOs的药物反应
为了验证在胃癌PDOs中的药物反应状态,研究人员建立了小鼠PDOX模型。通过在小鼠体内植入不同的胃癌类器官,发现G5T-PDOs对紫杉醇敏感,表现为肿瘤生长(图6C)和肿瘤重量(图6D)显著减少;对5-FU呈现出耐药性(图6B)。而且,与未治疗的对照组相比,紫杉醇治疗的G5T-PDOXs中的细胞增殖显著减少(p < 0.001),而细胞凋亡显著增加(p < 0.01),而在5-FU治疗组中未发现这种差异(图6E)。
此外,G9T-PDOs对5-FU敏感,对奥沙利铂呈现出耐药性(图6F)。5-FU治疗后,与未治疗的G9T-PDOXs相比,G9T-PDOXs中的细胞增殖显著减少(p < 0.0001),细胞凋亡显著增加(p < 0.01),而在奥沙利铂治疗组中未观察到差异(图6I)。
G27T-PDOs对5-FU、奥沙利铂和紫杉醇均敏感(图S7A),肿瘤生长和肿瘤重量也显著减少(图S7B和S7C);G30T-PDOs对奥沙利铂和紫杉醇敏感,但对5-FU部分耐药(图S7D);G72T-PDOXs对5-FU、奥沙利铂和SN-38敏感,也与G72T-PDOs的药物试验结果一致(图S7G–S7I)。
这些实验结果表明,在胃癌器官培养中观察到的药物反应在PDOX体内模型中得到了验证。
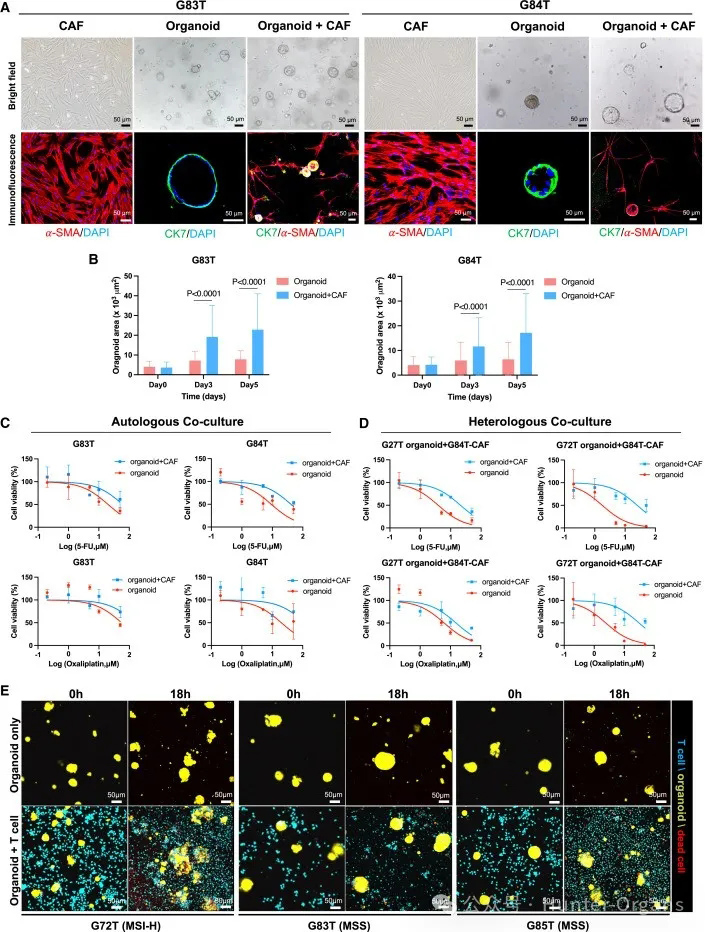
图7
10. 在随访的胃癌患者中验证GC PDOs的药物反应
通过实际临床治疗和随访中,研究人员验证了GC PDOs的药物敏感或耐药结果。随访12名接受化疗的胃癌患者,并结合其来源的类器官药物筛选结果(图6J和6K),发现有11名(91.7%)的药物反应结果与其来源的PDOs一致(图6K)。如,G32T患者被诊断为局部晚期胃癌,接受术后奥沙利铂和S-1辅助化疗,随访35个月无肿瘤复发,与实际临床反应一致,来源于G32T的类器官对联合治疗也很敏感。这些结果表明,GC PDOs的药物反应可在其对应的随访胃癌患者中得到验证,GC PDOs是药物筛选和预测患者药物反应的有力工具。
11. 类器官模型作为研究肿瘤微环境细胞与肿瘤细胞相互作用的平台
为了探讨类器官与成纤维细胞(CAFs)共培养的可能性,研究人员将胃癌类器官(G83T和G84T)与匹配的肿瘤相关成纤维细胞(CAFs)进行共培养。3天后,CAFs生长并逐渐形成包围类器官的网状结构(图7A);5天后,类器官体积显著增大(图7B和S8)。
随后,研究了在5-FU和奥沙利铂作用下,CAFs对肿瘤类器官的影响。结果显示,CAFs显著增强了两种类器官(G83T和G84T)对5-FU和奥沙利铂的耐药性(图7C)。与单独培养的类器官相比,共培养的类器官(G27T和G72T)增强了对药物的耐药性(图7D)。
为了进一步探究类器官与免疫细胞的相互作用,将来自三名患者的胃癌类器官与自体T细胞共培养。经过2周的共培养和刺激后,在G72T患者(MSI-H)中,暴露于自体肿瘤类器官的PBMCs干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)肿瘤反应性T细胞显著增加;G83T患者(MSS)中,IFN-γ略有增加,TNF-α肿瘤反应性T细胞显著增加;而G85T患者(MSS)中,IFN-γ略有增加,TNF-α肿瘤反应性T细胞减少(图S9A)。因此,这些患者特异的肿瘤反应性T细胞可用于共培养试验,以评估它们在类器官中的肿瘤杀伤作用。
综上所述,实验结果表明,通过PBMCs和自体肿瘤类器官的共培养,从而诱导患者特异的肿瘤反应性T细胞反应是可行的。自体T细胞的加入,通过免疫荧光染色可发现G72T类器官结构损伤、凋亡增加(图7E);流式细胞术证实,与T细胞共培养后,肿瘤细胞凋亡增加(图S9B),而在与T细胞共培养的G83T和G85T类器官中,未观察到此现象(图7E和S9B)。这些实验结果能验证肿瘤微环境细胞与肿瘤细胞之间的相互作用,以便深入了解这些相互作用如何影响治疗效果。
04、编者点评
综上,本研究建立了患者来源的胃癌类器官生物样本库,并分析了胃癌PDO的分子特征,还利用基于患者来源类器官的异种移植(PDOX)模型来验证PDO药物敏感性测试的结果,并进一步用胃癌个体患者的实际治疗反应进行验证。 这些结果表明,利用患者来源的胃癌类器官进行化疗敏感性评估,可作为胃癌患者化疗药物筛选的有价值工具。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!