业务咨询

![]() 发布时间:2025-06-06
发布时间:2025-06-06
![]() 环特生物
环特生物
![]() 浏览次数:1921
浏览次数:1921

编者按
当前,世界上每年约生产31亿条轮胎,N-(1,3-二甲基丁基)-N′-苯基对苯二胺(6PPD)因其优异的抗臭氧性能被广泛用于轮胎橡胶添加剂,当轮胎与路面摩擦时,轮胎磨损颗粒极易氧化分解为具有致畸和致突变的强毒性污染物——6PPD-醌(6PPDQ) 。6PPD及其氧化产物6PPD-醌表现出不同的急性毒性和生物蓄积性。
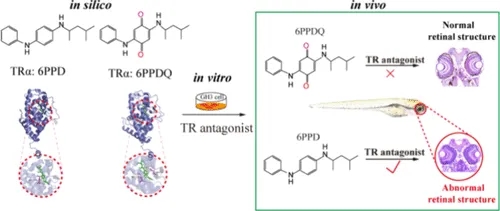
今天,我们分享由中国科学院生态环境研究中心研究团队发表在Environmental Science & Technology(IF=10.8)的一项最新研究成果。该研究通过细胞实验、斑马鱼实验等比较了轮胎添加剂6PPD及其转化产物6PPD-醌 (6PPDQ)对甲状腺的干扰作用,首次明确揭示了6PPD与6PPD-醌在斑马鱼视觉毒性上存在显著差异,并阐明了6PPD诱导眼损伤的具体分子通路,强调了在轮胎相关污染物中,6PPD而非6PPD-醌通过干扰甲状腺信号通路来损害水生生物视觉系统的重要风险物质,有助于未来对环境残留的监测与风险评估。
实验结果显示,尽管6PPD和6PPD-醌显示出与甲状腺激素受体 (TR) 亚型相似的结合亲和力及对GH3细胞的抑制作用,但仅在暴露于6PPD之后,斑马鱼的甲状腺信号通路、视觉发育、趋光行为及视网膜层的细胞密度才受到显著影响。进一步研究表明,6PPD可作为TR拮抗剂,降低视蛋白丰度并抑制视锥细胞增殖,最终改变斑马鱼视网膜层结构并导致斑马鱼小眼畸形。尤其当暴露在环境相关浓度下,6PPD 诱导了TRβ、opn1lw1、opn1mw1、rpe65a、nr2e3等基因表达的改变,但并未观察到明显的眼组织病理学变化。本研究首次阐明与6PPD-醌相比,6PPD对视觉系统的损伤更为严重,甲状腺信号通路的干扰是其中一个因素,而其他重要的毒性靶点仍需进一步研究。
文章题目
6PPD, Not 6PPD-Quinone, Induced Serious Zebrafish Eye Damage by Disrupting the Thyroid Signaling Pathway
杂志:Environmental Science & Technology(IF=10.8)
发表时间:2024年12月4日
作者:常静、王会利、万斌等
单位:中国科学院生态环境研究中心,环境化学与生态毒理学国家重点实验室等
01、研究亮点
• 首次揭示轮胎添加剂6PPD及其转化物6PPD-醌 (6PPDQ) 在斑马鱼视觉毒性上存在显著差异,证实了6PPD是导致严重眼损伤,如小眼畸形、视网膜结构破坏、视觉功能障碍的主要物质,而6PPD-醌在相同条件下未观察到类似的眼损伤效应;
• 阐明了6PPD诱导眼损伤的分子通路,表明6PPD作为甲状腺激素受体β (TRβ) 的拮抗剂,干扰甲状腺信号通路;
• 采用斑马鱼、细胞实验等方法,系统验证了6PPD的甲状腺干扰活性和眼毒性机制。
摘要
02、研究背景
N-(1,3-二甲基丁基)-N′-苯基对苯二胺(6PPD)因其优异的抗臭氧性能而被广泛用于轮胎橡胶添加剂。6PPD在欧洲各国的年产量约为1000-15000吨,在中国的年产量约为200000吨。6PPD可能通过生产、橡胶工业使用及橡胶产品的使用与处置等释放到环境中,并可以在污水处理厂、道路径流和轮胎磨损颗粒浸出液中被检测到,最终流入城市河流。
通过分析14种不同轮胎的洗脱液发现,中性水中的6PPD浓度范围为10-100μg/L;在拜耳布伦斯比特尔工厂 (Bayer Brunsbittel) ,其污水处理时6PPD的最大浓度达到0.24mg/L;在珠江三角洲地区,沉积物中6PPD的浓度为0.585-468 ng/g,地表径流中为0.19–7.52ng/L。6PPD-醌 (6PPDQ) 作为6PPD的关键毒性转化产物,在环境中比其前体物6PPD更稳定、更持久。在河流中检测到的6PPD-醌的浓度明显高于6PPD,道路径流和雨水中6PPD-醌的浓度范围为0.3-19.0μg/L。
6PPD和6PPD-醌在水系统中普遍存在,并对水生生物构成潜在威胁。如,6PPD对我国特有的一种小型鱼类——稀有鮈鲫具有高毒性,而6PPD-醌对虹鳟有剧毒,也是道路径流中导致银鲑死亡的主要有毒物质。有一项研究评估了6PPD在斑马鱼中的内分泌毒性,表明6PPD通过降低三碘甲腺原氨酸 (T3) 水平并增加甲状腺素 (T4) 水平,从而导致甲状腺功能失调。
我们之前的研究表明,轮胎磨损颗粒 (TWP) 浸出液中的甲状腺干扰性物质可诱导斑马鱼眼损伤。然而,TWP浸出液中损害斑马鱼视觉功能的关键污染物尚不清楚。因此,研究人员假设6PPD和6PPD-醌可能作为甲状腺干扰性物质,是TWP浸出液中诱导斑马鱼小眼畸形的潜在污染物。
甲状腺激素水平可调控视网膜中的视锥细胞亚型。甲状腺激素受体β(TRβ)和T3模拟长波(L)和中波(M)的视锥细胞,并抑制短波(S)视锥细胞,而甲状腺激素受体α(TRα)则诱导视锥细胞中紫外线视蛋白到蓝色视蛋白的可逆、时间依赖性转换。甲状激素和甲状腺激素受体调节视蛋白合成,对光感受器细胞的增殖至关重要。光感受器细胞的一个重要功能是将光信号转化为膜信号,从而调节视觉功能。鱼类的视觉感知对躲避捕食者和觅食行为至关重要。
尽管之前已提出6PPD对甲状腺激素水平具有干扰作用,但6PPD诱导的甲状腺功能减退是否引起视觉损伤尚不明确。此外,6PPD的转化产物6PPD-醌对银鲑表现出比6PPD更高的急性毒性。在本研究中,研究人员假设6PPD或6PPD-醌可能通过干扰甲状腺信号通路诱导视觉损伤。
斑马鱼及其胚胎,是研究甲状腺干扰物的重要水生模式生物。斑马鱼在受精后 72小时 (hpf) 开始产生T4,120hpf时其甲状腺滤泡完全形成。它们通体透明,便于观察化学暴露后的生理变化,且由于其基因与哺乳动物相似,在斑马鱼胚胎中观察到的许多毒性效应与在哺乳动物中观察到的毒性效应相一致,因此,斑马鱼被广泛用于测试化学物质的甲状腺毒性。体外实验,包括T-screen实验及模拟分子对接,可通过化合物与蛋白质受体的结合,来揭示化学物质对甲状腺信号通路的潜在影响。
本研究中,研究人员首先通过计算机模拟与体外实验确定了6PPD和6PPD-醌对甲状腺的干扰作用。通过对斑马鱼进行表型分析、甲状腺激素测量和基因表达分析,进一步证实了6PPD和6PPD-醌干扰甲状腺信号通路。通过分析眼组织病理学、光传导通路相关基因和蛋白表达水平,揭示了6PPD暴露后甲状腺干扰诱导的眼损伤。本研究不仅揭示了6PPD和6PPD-醌在斑马鱼中的不同毒性效应,还预测了6PPD在引起斑马鱼眼损伤的不良通路 (AOP)。
03、研究结果
1. 6PPD、6PPD-醌与甲状腺受体(TR)异构体的结合
先前的研究表明,6PPD是一种潜在的甲状腺信号干扰物,可以改变甲状腺激素水平并影响HPT轴相关基因表达。干扰甲状腺激素信号通路的关键是结合甲状腺激素受体 (TR)。本研究中,研究人员首先评估了6PPD和6PPD-醌与两种TR异构体——TRα、TRβ的结合活性。
与天然配体T3相比,TRA1、6PPD和6PPD-醌都能适用于TRα或TRβ活性,但结合效率低于T3。在T3、TRA1、6PPD和6PPD-醌与TRα、TRβ的复合物中分别观察到6个、10共同的结合残基,6PPD-醌与TRα的相互作用又与MET262、SER280形成了两个氢键。而对于TRβ,6PPD-醌也表现出比6PPD更高的结合亲和力,但均低于T3 ,6PPD和6PPD-醌与TRβ的结合亲和力比TRA1高1.3–1.4 倍,在T3、6PPD和6PPD-醌与TRβ的复合物中观察到1个共同的氢键 (MET238)。这些结果表明, 6PPD和6PPD-醌与甲状腺受体(TR)有很强的相互作用,且可能通过与TR的相互作用来干扰甲状腺受体活性。
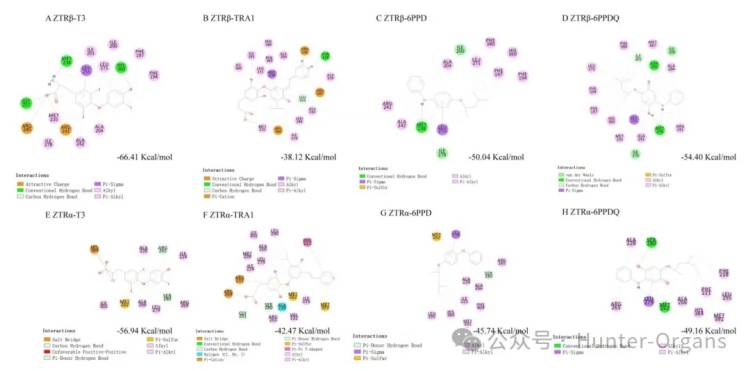
图1
2. 6PPD和6PPD-醌对GH3细胞增殖的影响
为了确定6PPD和6PPD-醌在细胞水平上的TR信号通路活性,研究人员进一步研究了它们对GH3细胞增殖的影响。M T3暴露显著增加了GH3细胞增殖,而在缺乏T3之下,6PPD或6PPD-醌暴露后的GH3细胞增殖则没有显著差异。这表明,6PPD和6PPD-醌不是TR激动剂。
已知的TR拮抗剂TRA1显著抑制了T3触发的GH3细胞增殖,抑制率为 24–48%,这表明了有效的拮抗反应。在拮抗实验中,随着6PPD浓度的增加,反应呈下降趋势,而6PPD-醌和TRA1暴露后的浓度反应则是非线性的。TRA1和6PPD-醌的异常浓度反应可能源于GH3细胞中复杂的分子。GH3细胞有TRs、甲状腺过氧化物酶和脱碘酶等许多酶,其增殖对T3水平很敏感。TRA1和6PPD-醌可能不仅与TR结合,还会影响脱碘酶的活性。
GH3细胞中的增殖效果反映了这些效应的综合作用,导致观察到的非线性浓度反应。类似的浓度-反应模式在先前的研究中也有出现。总之,与TRA1相比,6PPD 和6PPD-醌可能是潜在的甲状腺系统拮抗剂,电子模拟和体外实验都揭示了6PPD和 6PPD-醌对甲状腺激素信号的潜在干扰作用。
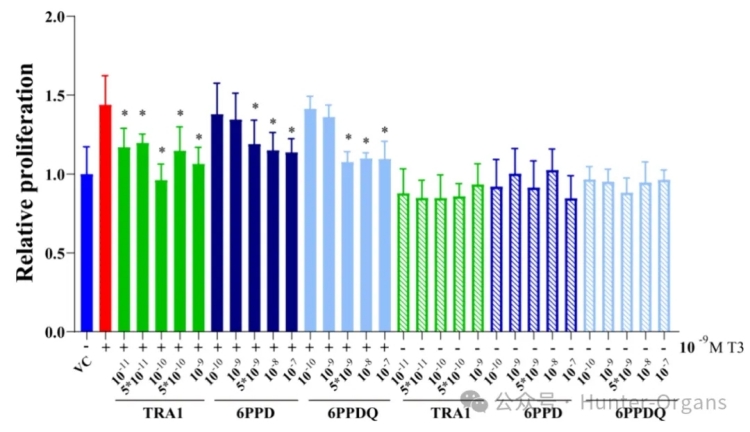
图2
3. 斑马鱼揭示6PPD和6PPD-醌的急性毒性及其不良后果
体外实验表明6PPD和6PPD-醌是潜在的甲状腺干扰物。斑马鱼的甲状腺内分泌系统可以调节斑马鱼胚胎的发育、生长和代谢等。为了通过斑马鱼实验进一步验证 6PPD和6PPD-醌的甲状腺干扰效应,研究人员选择斑马鱼胚胎作为理想模型,发现暴露于6PPD120h的斑马鱼胚胎半数致死浓度(LC50)为0.87mg/L,而暴露于浓度为10mg/L的6PPD-醌后未观察到显著的死亡率。
尽管6PPD-醌在银鲑中表现出非常高的急性毒性 (LC50为95ng/L),但暴露于6PPD-醌的斑马鱼急性毒性较低。因此,6PPD-醌的急性毒性呈现出物种特异性。鉴于暴露于6PPD比6PPD-醌的急性毒性高,因此要更加关注6PPD在斑马鱼中的毒性效应。
发育毒性分析结果显示,眼径与体长的比值随暴露浓度的增加而减小,且在暴露于0.1、0.2、0.4和0.8mg/L的6PPD中显著 (p<0.05) 减小。鱼鳔未扩张率也随浓度依赖性增加,且在0.2、0.4和0.8mg/L的6PPD暴露组中显著 (p<0.05) 增加。72h的孵化率仅在6PPD的高浓度暴露组 (>1.6mg/L) 中显著降低 (p<0.05)。
先前的急性毒性研究也表明,小眼和鱼鳔未扩张是暴露于6PPD后的两个主要的不良后果。眼睛和鱼鳔的形态和功能变化被用于评估鱼类甲状腺干扰物效应,这些表型的改变可能间接表明6PPD对HPT轴的潜在干扰。与对照组相比,6PPD-醌的暴露组的眼睛大小、孵化率和体长没有显著变化,但斑马鱼肠道中观察到褐色沉淀物。仅在2.0mg/L的6PPD-醌暴露组鱼鳔未扩张率显著增加(p<0.05),斑马鱼肠道免疫系统受到6PPD-醌暴露的干扰,导致肠道明显扩大。
然而,研究人员并不认为褐色沉淀物是由血液凝固的肠道引起的。由于肠道中的颜色与6PPD-醌粉末的颜色相似,研究人员推测褐色沉淀物表明6PPD-醌在肠道中具有生物积累性。最近的研究也支持此推测,即6PPD-醌更易于在成年斑马鱼肠道中积累。斑马鱼鱼鳔的扩张取决于连接肠道和鱼鳔腔气管。
考虑到未改变的体长、正常的眼睛大小及明显的肠道损伤等,鱼鳔未扩张率的增加可能与肠道病变相关,而非甲状腺系统的破坏。6PPD和6PPD-醌明显的表型差异表明,在亚致死浓度下,斑马鱼胚胎是由6PPD而非6PPD-醌作为甲状腺系统干扰物。
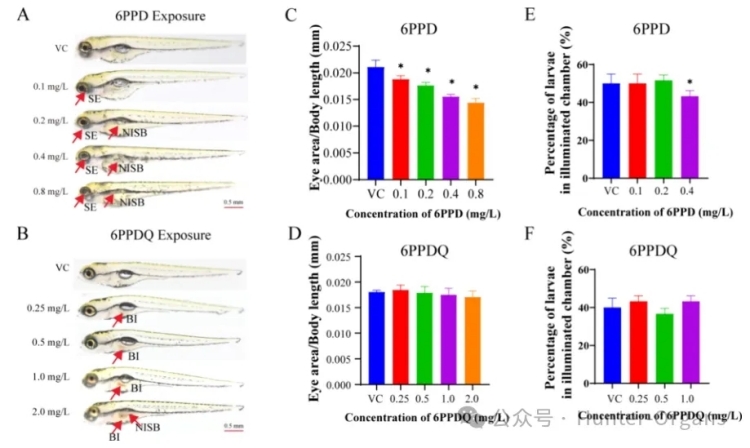
图3
4. 趋光行为异常仅在暴露于6PPD中观察到
随后,研究人员通过趋光行为实验进一步鉴定了眼睛的视觉损伤。在0.4mg/L的6PPD暴露组中,趋光行为被显著抑制 (p<0.05),而在6PPD-醌暴露组未观察到显著的变化(图3E,F)。这些结果证实了6PPD而非6PPD-醌影响了斑马鱼胚胎的视觉功能。
5. 6PPD而非6PPD-醌干扰了斑马鱼甲状腺系统
尽管体外实验表明6PPD和6PPD-醌都干扰了甲状腺激素受体信号通路,但斑马鱼胚胎暴露于6PPD-醌后未观察到明显的甲状腺干扰相关表型变化。因此,通过斑马鱼实验进一步证实了6PPD和6PPD-醌的甲状腺系统干扰效应。
研究人员首先在亚致死浓度下测量了对照组、阳性对照组 (TRA1)、6PPD和 6PPD-醌暴露组中的T3、T4等甲状腺激素水平。所有暴露组的T3水平均无显著增加,而T4水平随着6PPD暴露浓度的增加而增加。暴露于0.1和0.4mg/L的6PPD后,T4水平分别增加了14.7%和47.3%。阳性对照组TRA1暴露也诱导了T4水平增加了25.8%,这与6PPD暴露结果一致。而6PPD-醌暴露对T3和T4水平均没有显著影响。斑马鱼实验结果进一步证实,6PPD而非6PPD-醌破坏了斑马鱼的甲状腺系统。
为了进一步比较6PPD和6PPD-醌的甲状腺系统干扰机制,研究人员还对HPT 轴相关基因进行了定量分析,结果显示,基因转录水平随着6PPD暴露浓度的增加而增加。6PPD暴露后,tra、dio2、dio3和tpo基因的表达水平呈浓度依赖性增加,是甲状腺功能紊乱效应的重要生物标志物。与这些结果一致,TRA1、TR拮抗剂也显著上调了斑马鱼中tra、dio2基因的表达。可以预测,6PPD是一种潜在的TR拮抗剂。HPT轴相关基因的上调和T4水平的增加似乎是对TR活性抑制的负反馈效应。
此外,主要调节甲状腺激素合成的nis和tpo基因在6PPD暴露后也表现出显著的变化。6PPD可能不仅作为TR拮抗剂来抑制TR活性,还会中断甲状腺激素合成过程。因此,通过斑马鱼实验进一步证明了6PPD是一种甲状腺信号干扰物,而TR拮抗作用可能不是6PPD唯一的甲状腺干扰作用因素,6PPD的其他毒性靶点仍需进一步研究。暴露于6PPD-醌后,HPT轴相关基因的表达水平没有显著差异,这也与未改变的甲状腺激素水平一致。这些结果进一步证明6PPD-醌基本未对斑马鱼的甲状腺系统造成影响。
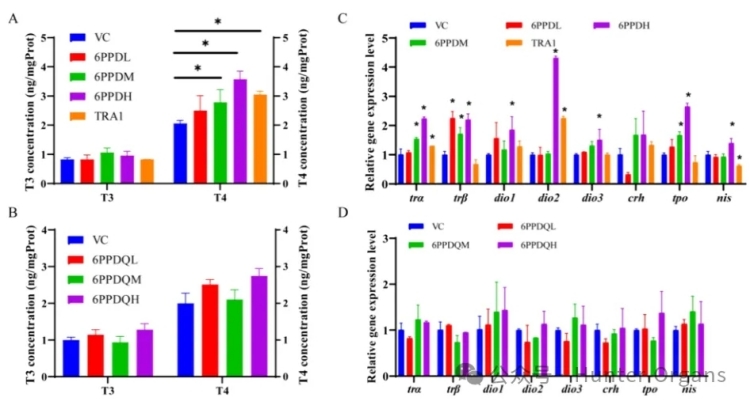
图4
6. 斑马鱼揭示6PPD而非6PPD-醌暴露诱导斑马鱼眼组织病理学损伤
作为一种潜在的甲状腺系统干扰物,最严重的不良后果之一是眼睛形态和功能的改变。因此,在暴露于6PPD或6PPD-醌后进行了斑马鱼眼组织病理学分析发现,暴露于0.4mg/L的6PPD后,视网膜神经节细胞层 (GCL)中的细胞密度显著增加了 22.1%(p<0.05);暴露于6PPD后,视网膜内核层 (INL)中的细胞密度没有显著变化;在视网膜外核层 (ONL) 中,细胞密度呈浓度依赖性下降,在低、中、高浓度的 6PPD组中分别下降了 28.5%、31.7% 和 51.9%。在0.1和0.4mg/L的6PPD暴露组中,ONL中的细胞密度均显著降低 (p<0.05)。
光感受器细胞主要位于视网膜的视网膜色素上皮 (RPE) 和ONL中,因此,暴露于6PPD后,尤其是在0.1和0.4mg/L的浓度下,感光细胞的数量可能会显著减少。在斑马鱼视网膜发育过程中,最早出现的视网膜细胞是GCL中的神经节细胞。减少的神经节细胞可以诱导祖细胞增加,从而调节光感受器细胞的分化。在本研究中,高浓度的6PPD暴露后,GCL中细胞密度的增加可能表明祖细胞增殖受到了抑制,最终导致视网膜ONL中光感受器细胞的细胞密度降低。
暴露于0.4mg/L的6PPD后,晶状体直径也显著减小,这可能导致眼睛变小。相比之下,暴露于高浓度的6PPD-醌后,晶状体直径、GCL、INL和ONL中的细胞密度没有显著的变化。眼组织病理学结果表明,暴露于6PPD而非6PPD-醌严重损害了斑马鱼的视网膜和晶状体,从而影响了眼睛发育。
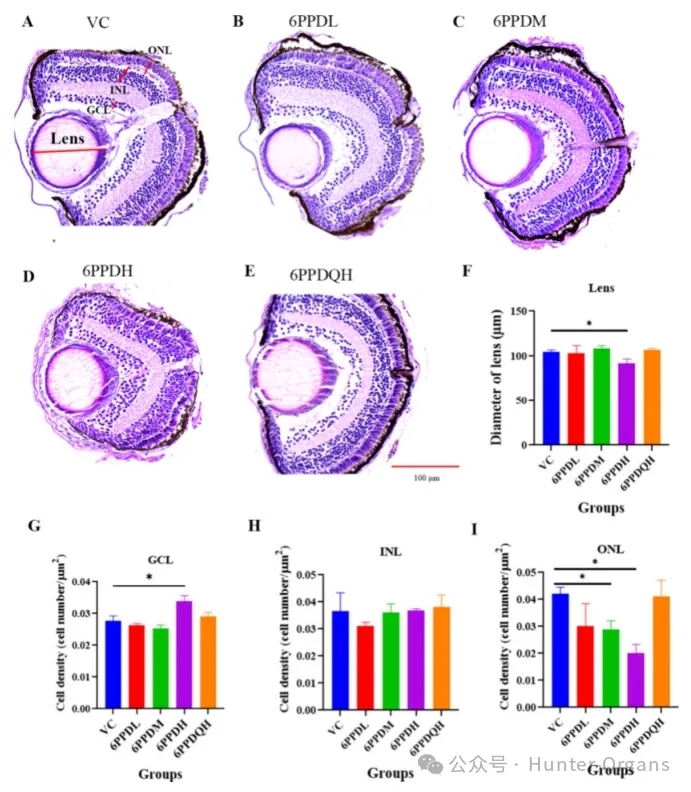
图5
7. 斑马鱼揭示暴露于6PPD后光转导功能受到破坏
本研究中,6PPD处理后ONL中光感受器细胞密度的降低可能进一步影响光转导功能。为了研究6PPD和TRA1暴露后的分子调控机制,研究人员对光转导通路中的基因表达和蛋白质水平进行了定量分析,结果表明,视蛋白基因表达的显著下降与视网膜INL中光感受器细胞密度的降低一致,这是暴露于6PPD或TRA1后的关键事件。相比之下,暴露于6PPD-醌后,未发现光转导相关基因存在浓度依赖性改变。
本研究还定量分析了TRA1或6PPD组中OPN1LW2、OPN1SW1、OPN1SW2、OPN1MW2 和GNAT2的相对蛋白丰度,结果显示:6PPD暴露显著下调光转导通路关键基因,特别是S-视锥细胞视蛋白基因opn1sw1, opn1sw2及其下游基因rho, pde6gb, gnat2。蛋白水平验证显示,OPN1SW1, OPN1SW2, OPN1LW2 和 GNAT2 蛋白丰度显著降低。TR 拮抗剂TRA1暴露也引起类似基因表达下调模式。
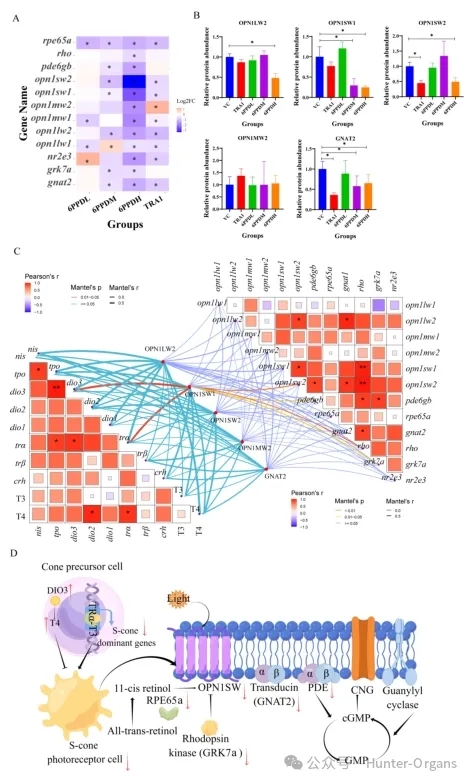
图6
8. 暴露于6PPD后斑马鱼视觉功能受损与甲状腺激素信号破坏相关
暴露于6PPD对斑马鱼胚胎的存活率和发育异常有显著的影响。本研究中,TR 拮抗剂 TRA1或6PPD暴露导致S-视锥细胞视蛋白丰度显著降低,OPN1SW1视蛋白的丰度与trα 和dio3基因表达高度相关(p<0.05)。因此,6PPD可能作为TR拮抗剂诱导眼损伤。
为了进一步证实这一假设,研究人员将已知的TR激动剂T3与6PPD共暴露,观察对眼睛发育的恢复效果。结果表明,T3与6PPD共暴露部分逆转了6PPD引起的眼睛尺寸减小、ONL 细胞密度降低、晶状体直径减小及部分光转导基因opn1mw2, opn1sw2, pde6gb的下调,支持甲状腺信号通路的核心作用。
总之,6PPD作为TRβ拮抗剂,会干扰甲状腺信号,特异性抑制S-视锥细胞视蛋白 OPN1SW)的合成,进而抑制视锥细胞增殖,最终导致视网膜结构破坏、晶状体发育受损、小眼畸形和视觉功能丧失等。
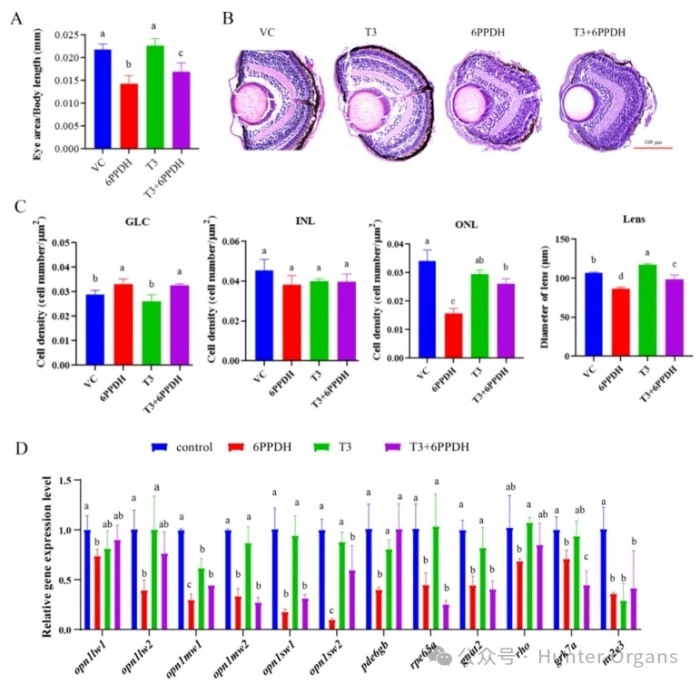
图7
04、编者点评
本研究首次揭示了轮胎添加剂6PPD与其转化产物6PPD-醌 (6PPDQ) 在斑马鱼视觉毒性上存在的显著差异,并通过斑马鱼实验、体外实验等强调了暴露于6PPD后甲状腺信号紊乱与视觉感知功能障碍之间的关系。
6PPD作为甲状腺激素受体β (TRβ)的拮抗剂,会干扰甲状腺信号通路,导致下丘脑-垂体-甲状腺 (HPT) 轴相关基因 trβ, tra, dio2, tpo 等表达显著上调,以及甲状腺激素水平改变等。6PPD作为一种新兴的污染物,其在环境相关浓度下对分子通路的干扰已构成风险,建议加强对水体中6PPD残留的监管及风险评估。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!