业务咨询

![]() 发布时间:2023-03-17
发布时间:2023-03-17
![]() 环特生物
环特生物
![]() 浏览次数:5614
浏览次数:5614

编者按:人肠道类器官(HIOs)是肠道器官发育和肠道生理相关研究的有力工具,但是免疫功能的缺失限制了HIOs在研究中更进一步的应用。那么,是否有免疫功能更完善的肠道类器官模型?如何在类器官上实现结构和免疫功能的互作?
今天我们来解读一项于2023年1月26日发表在《自然·生物技术》的最新研究——《In vivo development of immune tissue in human intestinal organoids transplanted into humanized mice》,该研究报道了一种包含人类免疫结构的HIOs,该研究为食物过敏、肠道感染疾病及肠道免疫发育相关研究提供了新模型及新见解。
一、研究背景
肠道是机体免疫系统中最大的组成部分,肠道的上皮层、固有层、淋巴滤泡等结构和其免疫功能发挥密切相关,这些结构被统称为肠道相关淋巴组织(GALT)[1]。肠道上皮层和肠道免疫的互作影响肠道发育、自身稳态和胃肠疾病等多个方面,在肠道生理研究中占据重要地位[2]。
多能干细胞来源的人肠道类器官(HIOs)提升了我们对人类肠道发育、生理、疾病等方面的认知[3,4]。但单纯的体外类器官模型因缺乏免疫细胞,限制了其在研究中的用途[5],即便是类器官与免疫细胞共培养的模型也无法很好的重现复杂的人类肠道免疫功能[6,7]。因此,一个能够模拟人类肠道免疫结构的体外模型显得尤为关键。在本文中,研究人员通过把HIOs移植到免疫系统人源化小鼠的肾包膜中,使HIOs的固有层和上皮层等结构浸润人的免疫细胞,模拟胎儿肠道淋巴滤泡的发育过程。该模型展示了HIOs上皮层和免疫细胞的体内互作,为后续的肠道免疫相关研究开辟了新的道路。
二、研究结果
1. 人的免疫细胞整合到了移植的HIOs中
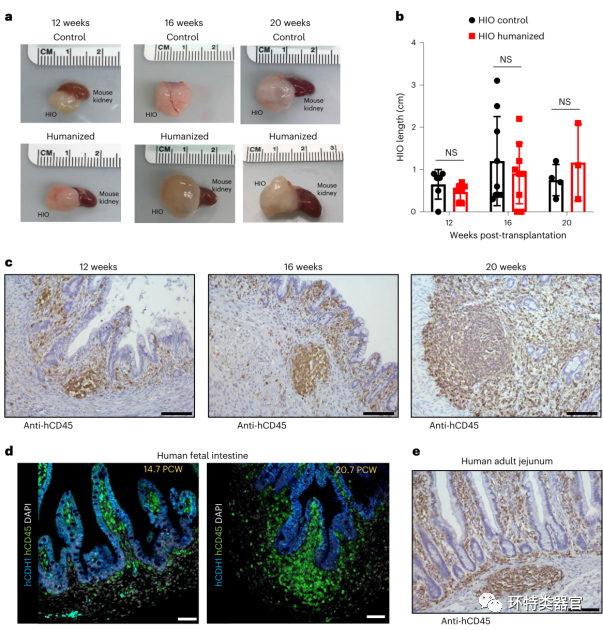
原文图1 利用免疫系统人源化小鼠将免疫细胞整合到HIO中
完成HIOs移植后,作者收集了移植后12、16和20周的样本,发现HIOs移植到免疫系统人源化和非人源化的小鼠中都能长到相似的尺寸,而且移植周期越长,HIO的大小呈现出的个体差异也越强,这一现象在免疫系统人源化和非人源化的小鼠中都存在,推测可能和HIO肠腔中的黏液逐渐积累,不能排出有关。以上结果说明,人源免疫细胞的存在不会影响移植的HIOs的正常生长。此外,免疫组化结果显示,人免疫细胞(CD45+)迁移到了HIO的粘膜层,且占据了固有层和上皮层,类似胎儿或者成人肠道中免疫细胞的聚集情况。
2. 鉴定免疫细胞类型和丰度
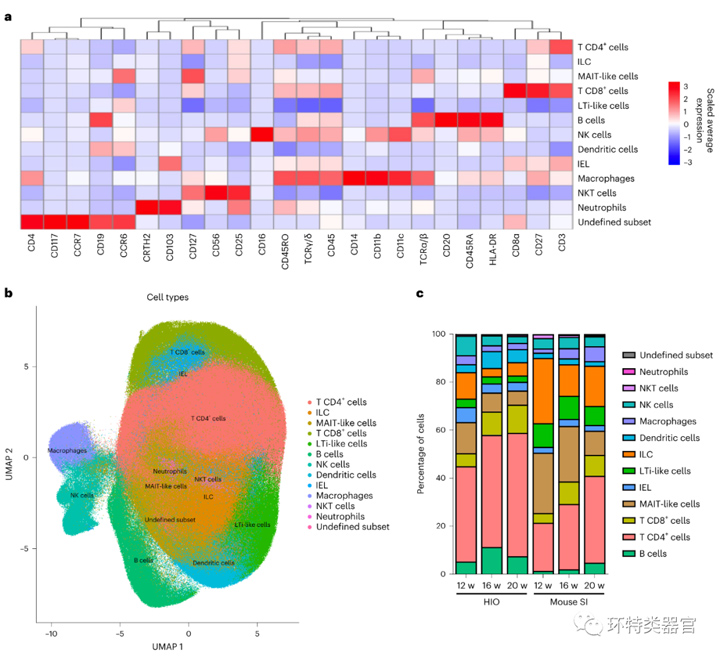
原文图 2 HIO和人源化小鼠小肠的免疫细胞特征分析
通过质谱流式细胞技术,能鉴定出12种主要的肠道内免疫细胞类型,并统计了每种免疫细胞在移植后随时间的丰度变化。此实验中对照组是人源化小鼠小肠,由于缺乏IL-2受体γ链(IL-2Rγ),所以缺少肠道淋巴滤泡和潘氏斑等免疫相关结构,导致T细胞和B细胞数量较少,这点也和实验结果吻合。HIO组T细胞和B细胞的数量处在一个较高的水平,说明HIO中可能存在类似肠道相关淋巴组织(GALT)的结构,能聚集相当数量的B细胞和T细胞。
3. 在发育的HIO中,免疫细胞聚集成类淋巴滤泡结构
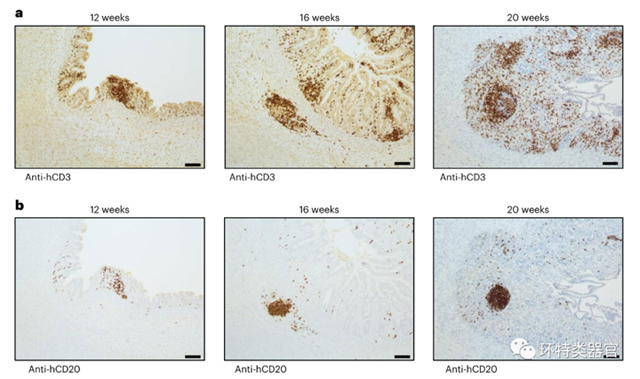
原文图 3 移植后HIO的免疫聚集物中含有B和T细胞
聚集起的免疫细胞在HIO的体内发育过程中逐渐形成了高度组织化的淋巴滤泡样的结构。淋巴滤泡是一种由T细胞包围B细胞而形成高度组织化的免疫功能相关结构。免疫组化结果显示,体内的HIO中有B细胞、T细胞聚集,并随着时间的发展,逐渐形成了分层明显的高度组织化状态,类似肠道中的淋巴滤泡结构。结合人源化小鼠小肠部位观察不到类似的免疫细胞聚集情况,说明HIO的体内发育过程也伴随着淋巴滤泡结构的产生和逐渐成熟。
4. HIO中淋巴滤泡样结构和人淋巴滤泡结构在发育上的时空相关性
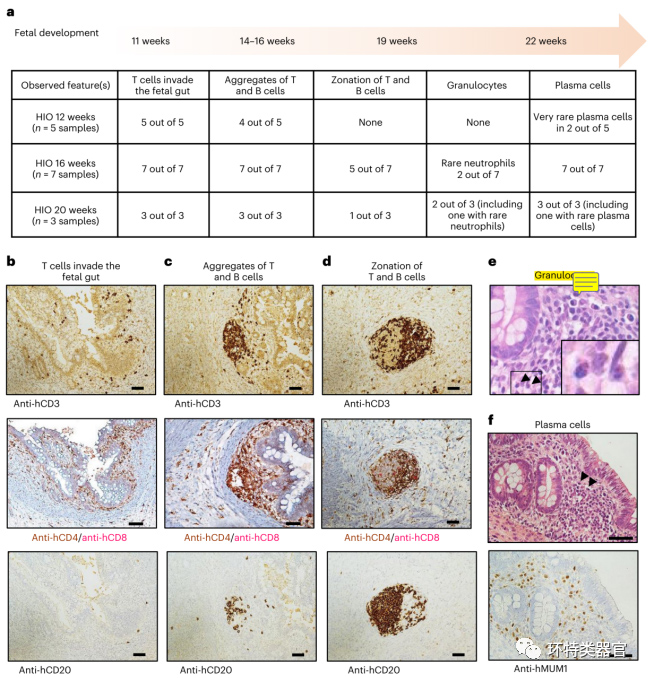
原文图 4 HIO移植后淋巴样结构与胎儿肠道淋巴发育的关系
在体的HIO由于缺乏抗原和微生物的暴露,其发育过程本质上类似于人胎儿的肠道发育,作者因此通过免疫组化和HE染色的方法对比了HIO中淋巴滤泡样结构和胎儿淋巴滤泡结构在发育上的时空相关性。结果显示,人胎儿的肠道发育中的典型事件:T细胞侵入、T细胞B细胞聚集、聚集体分层、出现粒细胞和浆细胞,在HIO的体内发育过程中都能找到类似的对应结果,并且这些结果在时间上呈现出与胎儿体内一致的先后次序。说明体内的HIO环境中表达了独特的信号,影响了免疫系统的成熟和淋巴组织的形成。
5. 微生物暴露可诱导移植的HIO中出现M细胞
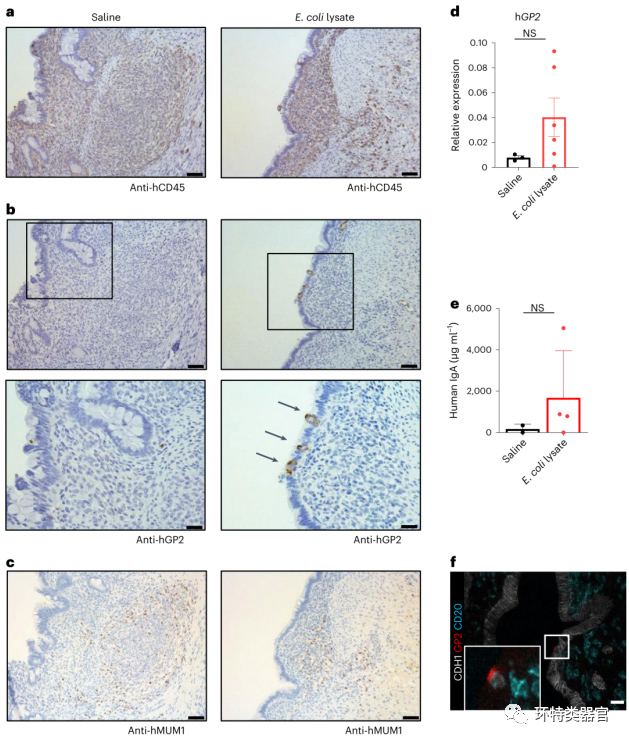
原文图 5 移植的HIO经微生物暴露后可诱导M细胞
M细胞散落分布于肠道上皮和淋巴滤泡间,是肠道免疫系统中特化的抗原转运细胞[2]。以前的研究揭示了上皮细胞和淋巴细胞的互作能有效促进M细胞的分化[8]。对M细胞特异性标志物——糖蛋白2(GP2)的免疫组化结果显示,在注射大肠杆菌裂解液处理72 h的HIO的上皮细胞表面鉴定出GP2,且覆盖在免疫细胞之上,符合预期。说明大肠杆菌暴露诱导了M细胞的产生,通过qPCR检测GP2在注射大肠杆菌裂解液组和注射生理盐水组的表达水平更进一步支持了这一结论。
M细胞介导的抗原转运是抗体IgA产生的前提条件[2],为了证实鉴定到的M细胞具有正常抗原转运功能,并能活化免疫细胞,作者检测了大肠杆菌裂解液注射过的移植HIO黏膜层的IgA表达水平以及浆细胞的产生情况,结果显示:虽然在实验组(注射大肠杆菌裂解液)和对照组(注射生理盐水)都检测到了浆细胞的产生,但实验组的IgA表达水平远高于对照组。
综上,肠道菌群暴露促进了移植的HIO上M细胞的产生,并能发挥正常的抗原转运和活化免疫细胞功能。
三、编者点评
本文构建了一种包含免疫结构的人肠道类器官。不同于免疫共培养的类器官模型,在体内发育的类器官可以展现出自身结构与免疫功能间的互相作用,具有较强的创新性,在肠道发育、肠道功能稳态等方面具有应用价值。但是,该模型构建繁琐,耗时较长(文中耗时半年),目前不适用于高通量的免疫疗法药物敏感性评价等工作。
作为斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展科研服务(CRO)、智慧实验室建设和精准医疗三大业务。目前,环特类器官平台已建立肿瘤类器官-免疫细胞共培养体系,在近期内将推出免疫疗法的敏感性检测服务,敬请期待!
参考资料:
[1] Mowat AM, Agace WW. Regional specialization within the intestinal immune system. Nat Rev Immunol. 2014 Oct;14(10):667-85.
[2] Rios D, Wood MB, Li J, Chassaing B, Gewirtz AT, Williams IR. Antigen sampling by intestinal M cells is the principal pathway initiating mucosal IgA production to commensal enteric bacteria. Mucosal Immunol. 2016 Jul;9(4):907-16.
[3] Sinagoga KL, Wells JM. Generating human intestinal tissues from pluripotent stem cells to study development and disease. EMBO J. 2015 May 5;34(9):1149-63.
[4] Singh A, Poling HM, Spence JR, Wells JM, Helmrath MA. Gastrointestinal organoids: a next-generation tool for modeling human development. Am J Physiol Gastrointest Liver Physiol. 2020 Sep 1;319(3):G375-G381.
[5] Noel G, Baetz NW, Staab JF, Donowitz M, Kovbasnjuk O, Pasetti MF, Zachos NC. A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Sci Rep. 2017 Mar 27;7:45270.
[6] Staab JF, Lemme-Dumit JM, Latanich R, Pasetti MF, Zachos NC. Co-Culture System of Human Enteroids/Colonoids with Innate Immune Cells. Curr Protoc Immunol. 2020 Dec;131(1):e113.
[7] Bar-Ephraim YE, Kretzschmar K, Clevers H. Organoids in immunological research. Nat Rev Immunol. 2020 May;20(5):279-293.
[8] Mabbott NA, Donaldson DS, Ohno H, Williams IR, Mahajan A. Microfold (M) cells: important immunosurveillance posts in the intestinal epithelium. Mucosal Immunol. 2013 Jul;6(4):666-77.