业务咨询

![]() 发布时间:2023-08-18
发布时间:2023-08-18
![]() 环特生物
环特生物
![]() 浏览次数:3627
浏览次数:3627

编者按
通过建立有效的三维培养系统,由临床肾细胞癌(RCC)标本构建RCC类器官,采用H&E染色、免疫荧光、全外显子组测序、RNA测序和单细胞RNA测序对RCC类器官进行了表征,通过测试RCC类器官对治疗药物和嵌合抗原受体(CAR-)T细胞的反应,评估其在个性化癌症治疗中的应用。
今天,我们回顾了一项于2022年7月8日发表在《临床转化医学》的经典研究——《Patient‐derived renal cell carcinoma organoids for personalized cancer therapy》,该研究通过患者来源的肾细胞癌类器官为学术研究和个性化医疗提供了有价值的临床前模型。
一、 研究背景
肾细胞癌(RCCs)的三个主要亚型是透明细胞肾癌(ccRCC)、乳头状肾癌(pRCC)和嫌色RCC(chRCC),分别占RCC的75%、15%和5%。
在临床上,RCC的治疗决策通常由疾病分期和其他因素来指导。但由于肾癌细胞通常对化疗药物不敏感,所以化疗不是大多数RCC的标准治疗选择。过去十年,已经批准了几种治疗肾癌的靶向治疗药物。然而,使用这些靶向药物并没有改善临床的情况。在个体中,由于广泛的肿瘤间异质性,靶向治疗的结果差异很大。
精准医疗,或个性化医疗,缺乏可靠的临床前模型来评估候选治疗方案的反应,然而患者衍生异种移植(PDX)模型可能影响肿瘤细胞对治疗的反应[8]。因此,迫切需要寻找一种合适的RCC研究模型,该模型能够忠实地代表这种疾病并允许进行药物测试。
在这里,作者建立了一个培养系统,利用成人RCC组织生成肿瘤类器官。利用该系统,作者成功获得了33例RCC类器官和10例正常肾脏类器官。接下来,作者提供了RCC类器官的典型特征,包括组织病理学特征、遗传突变景观、整体基因表达谱和细胞异质性。最后,使用RCC类器官评估患者对工程嵌合抗原受体(CAR)-T细胞和治疗药物的反应。
二、 研究结果
1、建立患者源性RCC类器官
本研究为了提高RCC类器官构建的成功率,作者测试了B-27 supplement,nicotinamide,R‐spondin1,noggin,N‐acetyl-L-cysteine,A83‐01, SB202190,FGF-10,EGF和Y27632这些生长因子对RCC类器官形成的影响。
结果表明,(1)除ccRCC‐27_O外,所有RCC类器官的形成都需要EGF;(2)A83-01、R-spondin1、noggin和FGF10不是所有测试的RCC类器官所必需的,因此被排除在培养基之外;(3)SB202190导致RCC类器官在ccRCC-21_O和ccRCC-29_O中显示出中空和囊性结构。
对于六个测试样本,我们发现R‐spondin1的缺失降低了正常肾脏类器官的生长,A83-01的缺失减少了正常肾类器官的生长。综上所述,RCC类器官和正常肾类器官对生态位因子的要求不同。
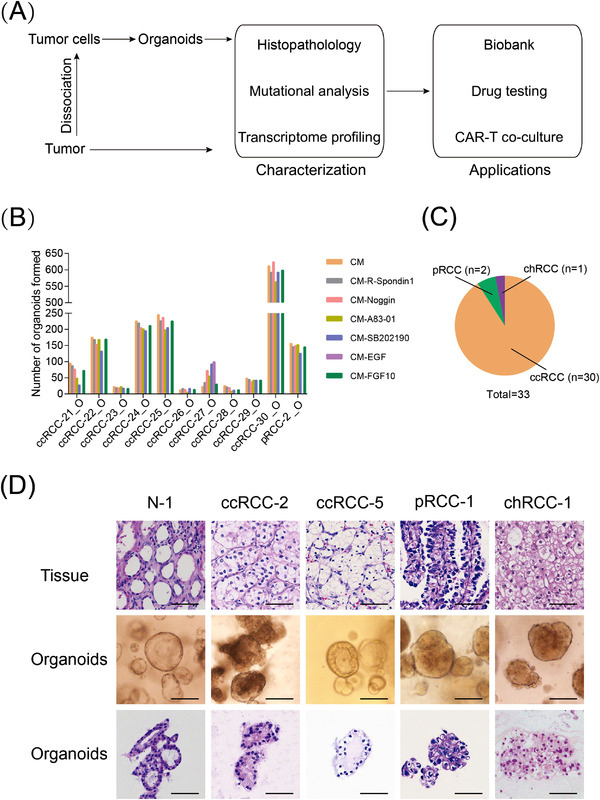
原文图1 建立患者源性RCC类器官生物库
2、RCC类器官保持了原发肿瘤的组织病理学特征
作者进行苏木精-伊红(H&E)染色,以测试RCC类器官是否保持其亲代肿瘤的组织病理学特征。结果表明,RCC类器官保留了其亲代肿瘤的组织学模式。接下来,作者检查了RCC亚型特异性标志物在RCC类器官和匹配肿瘤中的表达模式,以进一步表征已建立的RCC类器官。作者还对RCC类器官和亲代肿瘤中的PAX2、E-cadherin和Ki-67进行了染色。结果表明,在每个标志物的表达上,每个RCC类器官细胞都显示出与其亲代肿瘤相似的表达模式。
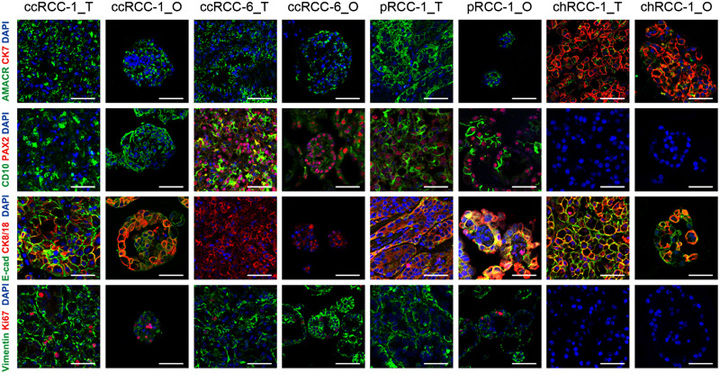
原文图2 患者源性RCC的类器官保留了原始肿瘤的组织病理学特征
3、RCC类器官保留了相应肿瘤的遗传突变景观
作者为了测试RCC类器官是否保留了其亲代肿瘤的突变景观,对16个已建立的RCC类器官及其匹配的肿瘤样本进行了全外显子序列测定(WES)。WES数据的对比分析显示,RCC组织中的碱基取代在其RCC类器官中得到了很好的保留。
此外,RCC组织和类器官中最常见和最不常见的碱基取代分别是C>T/G>A转变(Ti)和T>G/A>C转变(Tv),这与之前的描述一致,拷贝数改变(CNA)分析表明,RCC类器官和肿瘤组织之间的DNA增益和丢失也是保守的。总之,作者证明RCC类器官保留了RCC肿瘤的突变景观,包括体细胞突变、体细胞碱基替换和CNAs。
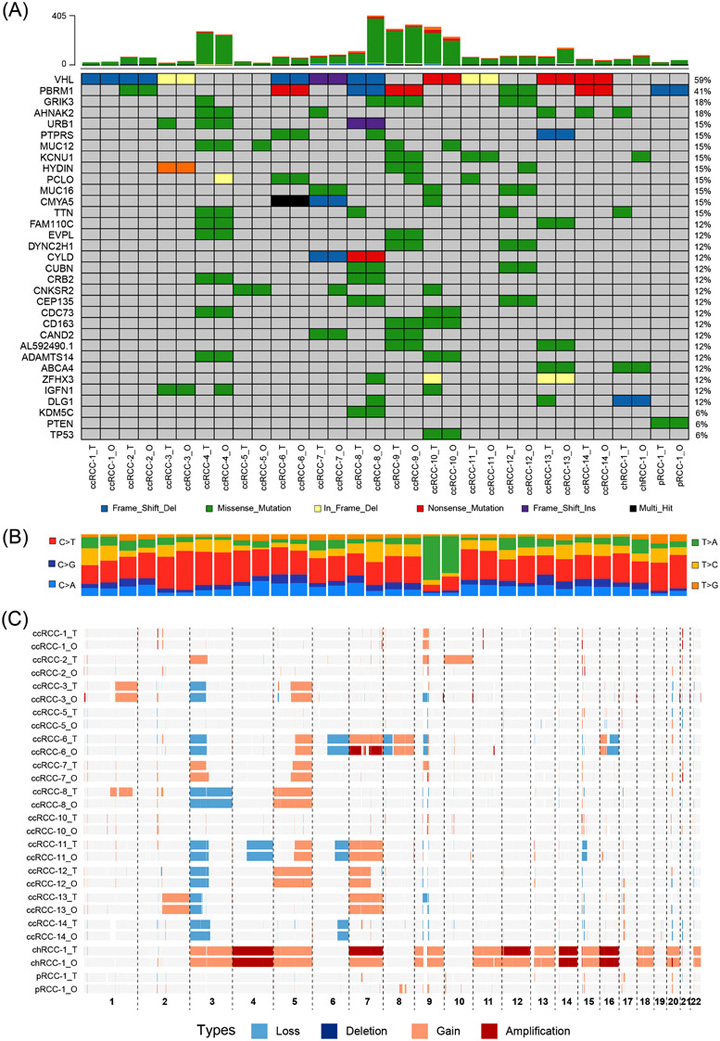
原文图3 RCC类器官概括了亲代肿瘤的遗传改变
4、RCC类器官的转录分析
为了确定作者的RCC类器官是否保留了原始肿瘤的基因表达谱,我们对16个RCC肿瘤-类器官对进行了RNA测序(RNA-seq)。共有1844个基因在肿瘤组织和肿瘤类器官之间存在差异表达,如CD4、CD8、PDCD1、HLA-DMA和CX3CR1,主要与免疫反应和炎症反应相关。
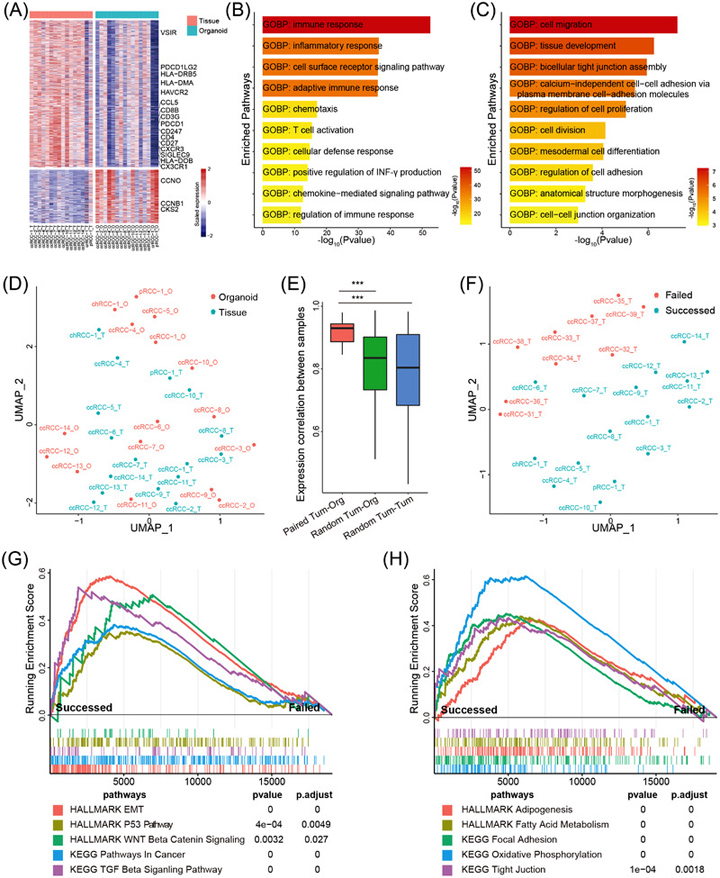
原文图4 RCC类器官的转录组分析
为了确定成功构建肿瘤类器官所需的组织特征,作者比较了成功构建出肿瘤类器官的16个RCC组织的转录组与9个无法构建肿瘤类器官的RCC组织转录组数据。UMAP分析显示两组RCC样本之间存在明显的转录组差异。
成功构建类器官的RCC组织中,与干细胞(WNT6/11、FZD8/9和JAG2)、细胞基质(MMP2、COL1A1)、脂肪代谢(ACOT2、LIPE)和癌症发展(TGFB1、SMAD6/7、EGF和FGF1)相关的基因高表达。这些数据表明,干细胞相关特性的丰富和基因组稳定性可能是成功建立RCC类器官的关键。
5、RCC类器官可用于识别潜在的肿瘤生物标记物
作者将RCC类器官的RNA-seq数据与正常肾类器官(N-1_O、N-2_O、N-3_O和N4_O)的RNA-seq数据进行比较,以评估RCC类器官作为识别肿瘤生物标志物平台的潜力。
作者进一步分析了30个P值最低的上调基因和30个下调基因,在这些基因当中有20个基因在RCC中被报道上调,7个基因在RCC中被报道下调,包括SOX2、NDUFA4L2、C1QA、C1QB和C1QC。然后作者利用TCGA数据,根据cox比例风险模型进行生存分析,评估其余基因的预后值。在KIRP队列和KICH队列中,MORC4和SLC26A2分别与预后显著相关。这些结果表明,RCC类器官可以作为识别潜在肿瘤生物标志物的模型。
6、scRNA‐seq揭示了RCC类器官内的细胞异质性
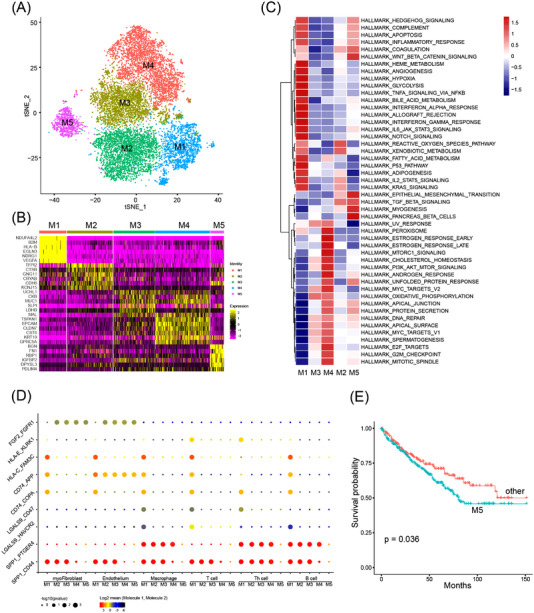
原文图5 通过单细胞RNA测序分析肾透明细胞癌(ccRCC)类器官的细胞异质性
作者对三种RCC类器官系进行单细胞RNA测序以表征细胞异质性。结果表明,这些RCC类器官主要由上皮肿瘤细胞组成。小部分肿瘤微环境(TME)细胞,如内皮细胞、肌成纤维细胞和免疫细胞。而且每个RCC类器官系都含有不同的TME细胞成分。
最新的研究表明,RCC活检中的肿瘤细胞形成两个主要簇,即肿瘤程序1(TP1)和肿瘤程序2(TP2)。VISION评分的基因特征表明,每个簇中丰富了不同的基因集。SCENIC分析显示,每个簇中的癌细胞受不同的调节子调控。这些数据表明,RCC细胞有三种不同的细胞命运。

原文图6 患者衍生RCC类器官的药物筛选
接下来,作者使用Monocle 2进行伪时间分析以推断RCC细胞的可能细胞命运,结果显示三个分支,分支1的细胞主要属于ccRCC-7_O,而分支2和3的细胞主要存在于ccRCC-2_O和ccRCC-15_O中。
药物筛选结果表明,ccRCC-2_O和ccRCC-7_O对mTOR、ERK和MEK信号通路抑制剂的反应存在差异。对scRNA-seq数据的分析表明,这些靶向治疗中的靶基因和相应的信号通路在癌细胞亚群之间被差异激活,并且这些靶向治疗中的靶基因和相应的信号通路在癌细胞亚群之间被差异激活。
7、RCC类器官的药物反应
为了探讨RCC类器官作为肿瘤替代物预测治疗方案的反应,作者对16个RCC类器官进行了药物筛选。与之前的报道一致,RCC类器官对常规化疗药物具有耐药性,IC50值较大。在类器官系中,对化疗药物的反应表现出显著差异。
在这项研究中,作者评估了这些靶向药物对既定RCC类器官的反应。药物筛选结果显示,作者的大多数RCC类器官对RTK信号通路抑制剂应答不佳。相反,作者观察到mTOR抑制剂依维莫司、替西莫司和AZD8055对类器官形成明显的抑制作用。作者还发现,一些尚未被批准用于治疗RCC的靶向药物,在杀死RCC类器官方面显示出有前景的结果,包括AKT抑制剂MK-2206、MEK1/2抑制剂曲美替尼和ERK1/2抑制剂SCH772984。
8、使用RCC类器官评估CAR介导的细胞毒性
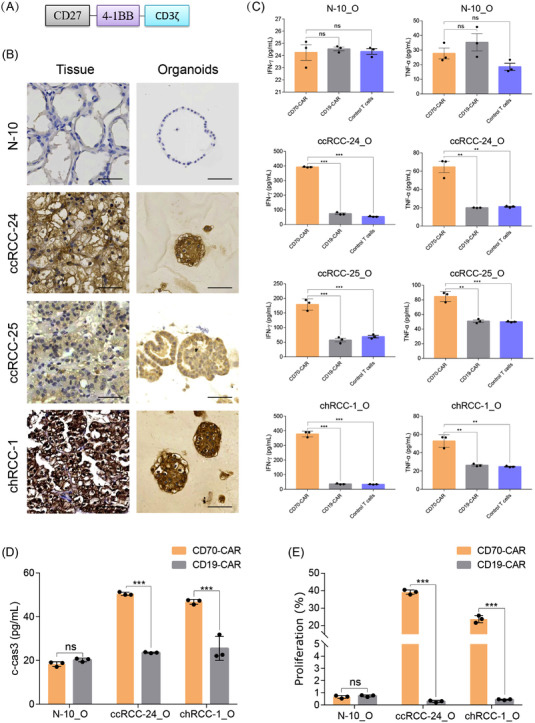
原文图7 RCC类器官和嵌合抗原受体(CAR)-T细胞共培养的免疫治疗模型
作者为了探索RCC类器官模型在预测患者对CAR-T细胞反应方面的效用,采用了一种共培养系统来培养RCC类器官和CAR-T细胞,通过免疫组织化学获得了10个RCC肿瘤样本中广泛使用的CAR-T治疗靶点的表达谱。在这些抗原中,CD70在一些测试样本中高度表达,因此在本研究中被用作靶标。
相比之下,当与正常肾类器官共培养时,CD70 CAR-T细胞并没有增加IFN-γ和TNF-α的产生,这表明CD70 CAR-T细胞具有较高的特异性活性。与CD70 CAR-T细胞共培养后,CD70+ RCC类器官中Cleaved Caspase-3信号也增加,表明CD70 CAR-T细胞特异性靶向并杀死了CD70+ RCC细胞。这些结果表明,建立的RCC类器官为评估抗原特异性CAR-T细胞的功效提供了一个新的平台。
三、 编者点评
作者通过测试RCC类器官对每个生态因子的依赖性,优化了RCC类器官培养基的组成,从而大大降低了研发成本。为了评估RCC类器官作为知道精准医学的工具的使用,作者对已建立的RCC类器官进行药物筛选,从而突出了选择适当方案的必要性。但该研究中建立的肿瘤类器官模型没有保存TME,如基质和免疫细胞,这限制了它们在评估抗血管生成药物和免疫检查点抑制剂疗效方面的应用。综上所述,RCC类器官保留了其原有肿瘤组织的特征,可推进RCC的基础研究,促进精准医学的发展!
作为斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展科研及研究服务、智慧实验室建设和精准医疗三大业务。目前,环特类器官平台已建立肾癌及多种癌种的类器官培养平台,欢迎有需要的读者垂询!
参考文献
[1]Hsieh JJ, Purdue MP, Signoretti S, et al.Renal cell carcinoma.Nat Rev Dis Primers. 2017;3:17009.
[2]Cancer Genome Atlas Research Network.Comprehensive molecular characterization of clear cell renal cell carcinoma.Nature. 2013;499(7456):43‐49.
[3]Linehan WM, Spellman PT, Ricketts CJ, et al.Comprehensive molecular characterization of papillary renal‐cell carcinoma.N Engl J Med. 2016;374(2):135‐145.
[4]Davis CF, Ricketts CJ, Wang M, et al.The somatic genomic landscape of chromophobe renal cell carcinoma.Cancer Cell. 2014;26(3):319‐330.
[5]Haas NB, Manola J, Uzzo RG, et al.Adjuvant sunitinib or sorafenib for high‐risk, non‐metastatic renal‐cell carcinoma (ECOG‐ACRIN E2805): a double‐blind, placebo‐controlled, randomised, phase 3trial.Lancet.2016;387(10032):2008‐2016.
[6]Beaumont JL, Butt Z, Baladi J, et al.Patient‐reported outcomes in a phase III study of everolimus versus placebo in patients with metastatic carcinoma of the kidney that has progressed on vascular endothelial growth factor receptor tyrosine kinase inhibitor therapy.Oncologist. 2011;16(5):632‐640.
[7]Motzer RJ, McCann L, Deen K.Pazopanib versus sunitinib in renal cancer.N Engl J Med. 2013;369(20):1968‐1970.
[8]Yuan Z, Fan X, Zhu JJ, et al.Presence of complete murine viral genome sequences in patient‐derived xenografts.Nat Commun. 2021;12(1):2031.