业务咨询
![]() 发布时间:2023-09-01
发布时间:2023-09-01
![]() 环特生物
环特生物
![]() 浏览次数:3461
浏览次数:3461

编者按
细胞与细胞间(CC)以及细胞与基质间(CM)的粘附对于上皮细胞的存活至关重要,然而在恶性细胞中,解离诱导的凋亡经常被规避。研究人员发现在传代过程中短期添加rho相关激酶(ROCK)抑制剂可有效改善细胞间解离诱导的细胞凋亡。已知三维类器官的培养依赖于细胞因子和Matrigel(富含基底膜基质材料)的补给,它们提供了必要的细胞-基质(CM)粘附生存信号。正常上皮细胞的三维类器官培养需要短期添加ROCK抑制剂(Y-27632),以抑制刚从组织中分离及培养过程中单个细胞解离诱导的凋亡。鉴于ROCK抑制对规避CC解离的重要性,在上皮系统中,它在癌症过程中的参与在很大程度上尚未被探索。
今天,我们解读一项于2022年发表在胃肠肝病学权威期刊《Gut》(IF=31.793)的研究,在本研究中,研究人员基于不同临床阶段和形态学的胃癌类器官系统地探索了其对Matrigel和ROCK抑制剂的依赖,并与临床数据关联,发现获得细胞-基质(CMi)或细胞-细胞(CCi)粘附独立或两者兼有(CMi/CCi)是区分癌症与正常类器官的关键特征,是癌症侵袭和转移的一个关键环节。这支持了rho - rock介导的细胞凋亡逃逸作为癌症发展的一般特征的重要性,通过进一步研究实现这种逃逸的可能机制有望为癌症治疗提供新策略。
主要研究成果
1、对胃类器官生物库中的不同亚型的肿瘤类器官及正常类器官依次进行transwell 迁移实验测试、ROCK 抑制剂(Y-27632)的停用试验以及成球测试,发现CMi和CCi的获得会增加类器官的迁移能力,促进肿瘤的发展及转移。
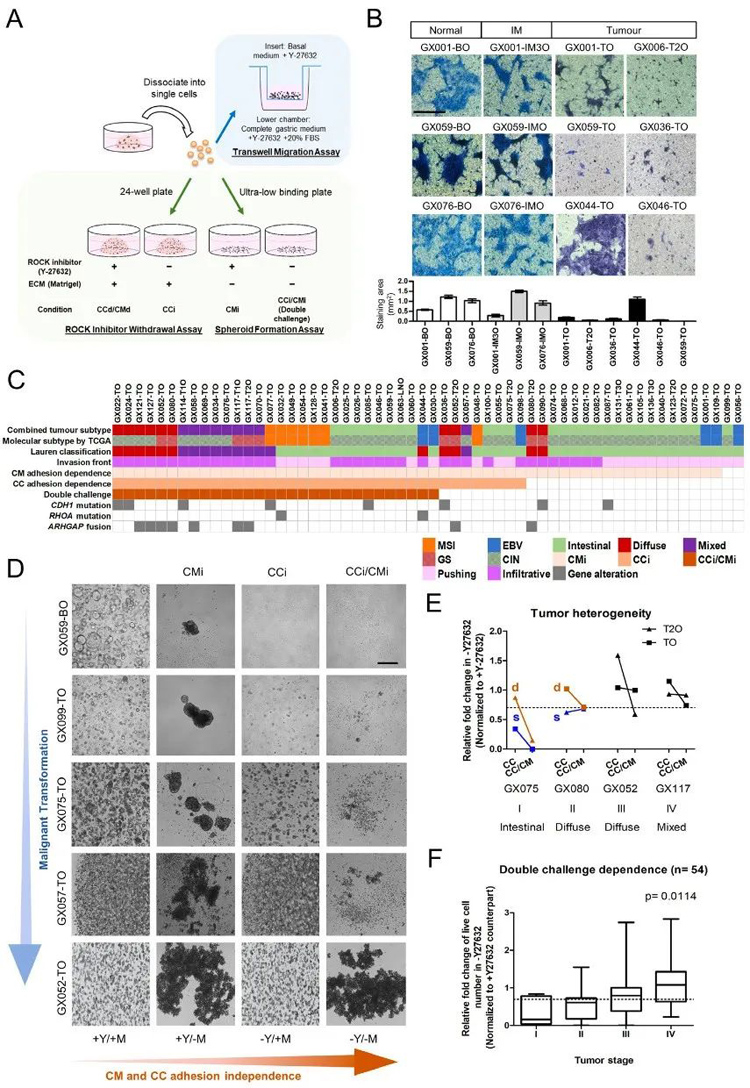
图1
2、将类器官CC或CM的粘附依赖性进一步关联样本临床病理参数,发现来自MSI和混合亚型的所有肿瘤类器官以及80%的弥漫性亚型类器官均为CCi;而57.7%的肠道和50%的ebv阳性肿瘤类器官为CCd。
对这些GC类器官来源的肿瘤组织检查显示CCi/CMi表型与体内浸润性肿瘤边缘、肿瘤分期进展以及较短的总生存期和无病生存期相关。
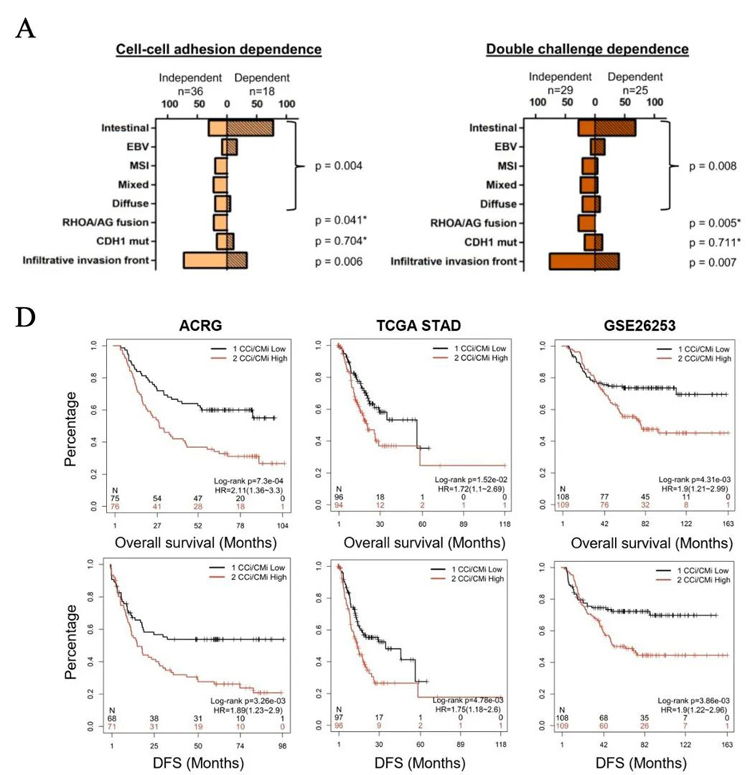
图2
3、作为一种具有极端侵袭性的CCi/CMi表型,对ROCK抑制剂的依赖性丧失最好的例证是ARHGAP融合或RHOA突变的弥漫性胃癌类器官。
研究人员通过Cas9系统构建ARHGAP融合特异性KO类器官,并通过撤除ROCK抑制剂和成球试验探究这些表型是否由ARHGAP融合转录本自身介导。结果显示所有融合的KO类器官克隆对CC解离诱导的凋亡表现出显著的再敏感性;成球实验结果显示与亲本类器官相比,融合的KO类器官克隆对CM黏附依赖性更强,在没有Matrigel的情况下,生长速度显著降低;而所有的KO克隆对双重调控都变得超敏感。
这些数据结果证明了ARHGAP融合的重要性,特别是CLDN18-ARHGAP26的融合,继而解释为什么这种特异性融合是胃癌患者中观察到的主要类型。
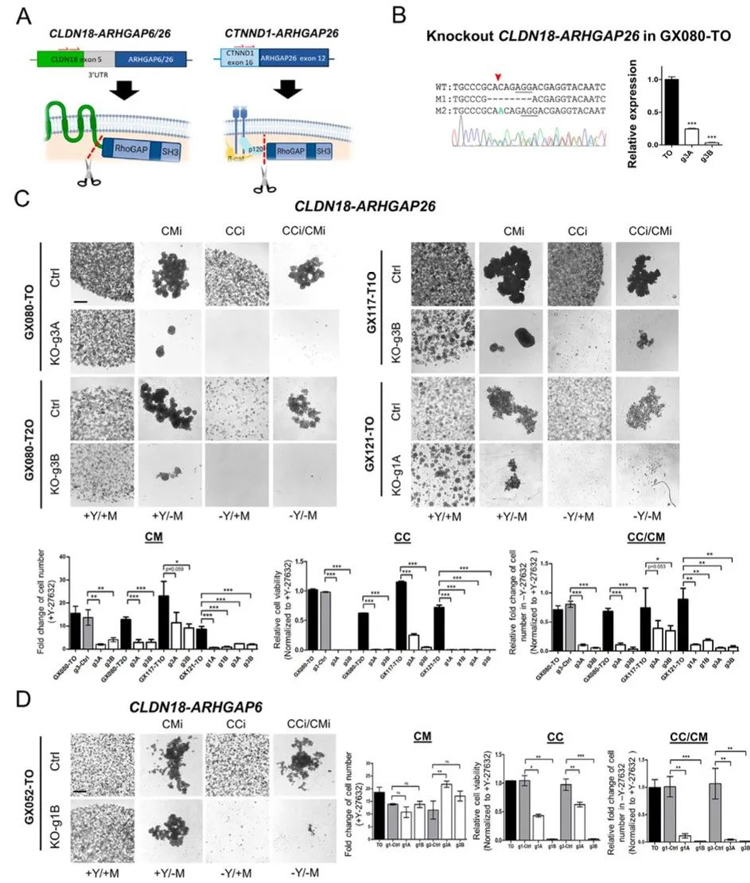
图3
4、对代表性的ARHGAP融合类器官进行了RNA测序,GSEA分析显示,在ROCK抑制剂停用的条件下,ARHGAP融合KO克隆较未诱导的亲本对照在局灶粘附、紧密连接、肌动蛋白细胞骨架等途径基因显著富集,进一步支持ARHGAP融合介导CC和CM粘连独立性的功能。
采用原位异种移植模型将荧光素酶标记的ARHGAP融合或ARHGAP融合KO 类器官接种于NSG小鼠胃粘膜下层,饲养三个半月后观察,发现融合阳性组胃癌发生率远高于融合KO组(67% vs 33%);肿瘤面积更大,呈弥漫性形态,具有大的间质室;肿瘤细胞在ARHGAP融合KO组的增殖速度明显下降,与体外功能表征结果一致。这些数据表明ARHGAP融合的肿瘤形成能力与CC和CM的附着独立性密切相关。
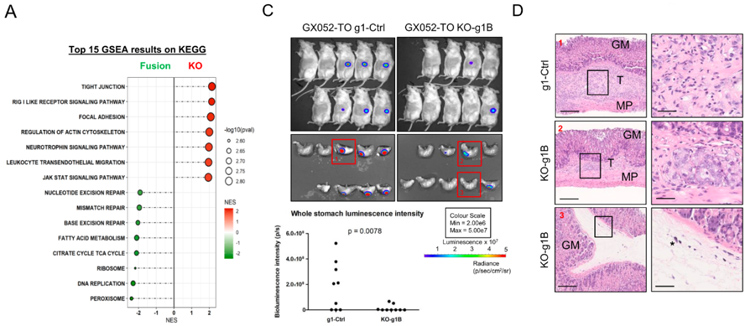
图4
作为斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展科研及研究服务、智慧实验室建设和精准医疗三大业务。目前,环特类器官平台已成功搭建多种肿瘤及正常类器官的培养平台,已有多种肿瘤类器官培养试剂盒和试剂在售,欢迎各位读者垂询!
参考文献
[1]Frisch SM, Francis H. Disruption of epithelial cell-matrix interactions induces apoptosis. J Cell Biol 1994; 124: 619-626
[2] Meredith JE, Fazeli B, Schwartz MA. The extracellular matrix as a cell survival factor. Mol Biol Cell 1993; 4: 953-961.
[3] Watanabe K, Ueno M, Kamiya D, et al. A rock inhibitor permits survival of dissociated human embryonic stem cells. Nat Biotechnol 2007; 25: 681-686.
[4] Sato T, Vries RG, Snippert HJ, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature 2009; 459: 262-265.


