业务咨询

![]() 发布时间:2023-12-08
发布时间:2023-12-08
![]() 环特生物
环特生物
![]() 浏览次数:3602
浏览次数:3602

编者按
唾液对润滑、消化、免疫和口腔内平衡至关重要。唾液腺由腮腺 (PG)、下颌腺 (SMG)和舌下腺 (SLG) 三个主要腺体组成,其负责约人类90%的唾液分泌。PGs主要为浆液腺泡细胞,分泌水样唾液;SLGs主要由粘液腺泡组成,产生粘稠和富含黏液的唾液;而SMGs兼具分泌浆液和粘液腺泡蛋白。尽管这三种唾液腺在产生不同唾液成分方面具有明显的细胞异质性,但它们具有共同的表型特征,包括管状细胞和基底细胞,以及由肌上皮包围的腺泡。
前期研究表明唾液腺类器官可以由唾液腺衍生的干细胞或祖细胞,非唾液腺上皮干细胞产生。研究人员尝试不同的细胞外基质组合,包括透明质酸水凝胶、去细胞化的唾腺支架或3D支架培养系统进行唾液腺类器官的构建,但这些类器官显示出一些不规则的标记表达模式,与在组织中观察到的完全不同。为了克服阻碍唾液腺结构和功能三维体系培养的技术障碍,了解唾液腺干祖细胞的可塑性和细胞-微环境相互作用的生态位信号非常重要。
今天,我们特别关注一项于2022年6月发表在《Nat Commun》的研究——Salivary gland organoid culture maintains distinct glandular properties of murine and human major salivary glands,该研究通过完善培养条件,成功建立了可长期培养的唾液腺类器官,包括来自小鼠和人类主要唾液腺的唾液腺腺泡、导管和肌上皮细胞。这些类器官在表型和功能上都再现了来源唾液腺的结构和腺体特异性分泌功能的异质性。此外,该培养体系能够从人类唾液腺良性和恶性肿瘤中培养出保留其特征的肿瘤类器官。近似组织的唾液腺类器官可扩大对唾液腺细胞间相互作用的见解,缩小体外和体内复杂唾液腺器官之间的差距。
一、主要研究成果
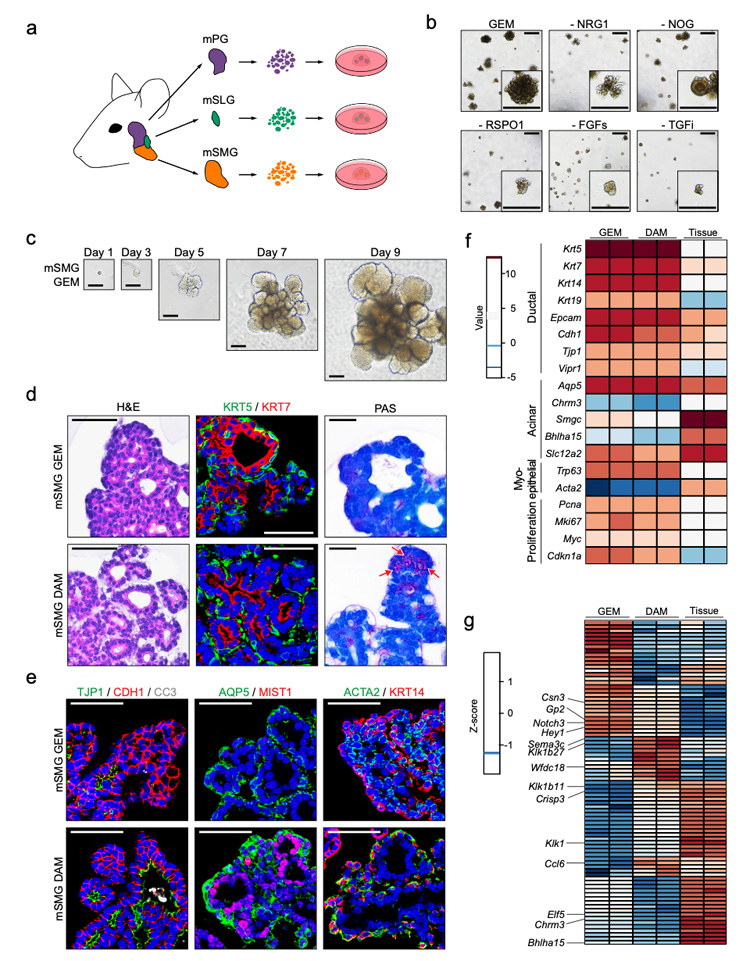
1、以小鼠SMGs为研究对象,对类器官构建所需的多种生长因子及小分子进行考察优化。研究发现NRG1可通过诱导Wnt的内源性表达来替代EGF和Wnt3a-CM,最终含有维甲酸、FGFs、Noggin及NRG1的培养体系可较好地维持类器官的生长及扩增,小鼠SMG类器官在长达8个月培养中,其导管和腺泡前标记物持续稳健表达。
但是,该阶段的类器官中未能检测到成熟的腺泡细胞及黏液细胞标志物的阳性表达。研究人员调整培养体系,通过加入Notch抑制剂DAPT进一步对类器官进行分化培养,使得类器官表现出更多的唾液腺样特征,包括端芽样结构的粘蛋白阳性细胞、紧密连接的管腔细胞、MIST1+的腺泡细胞和最外层的ACTA2+肌上皮细胞。已知唾液腺的功能由副交感神经或交感神经分泌的神经递质调节,研究人员使用多种神经递质处理类器官,其呈现出肿胀形态,钙内流增加,而后者为水分泌所必需的。
上述数据表明,建立的培养体系成功地维持了小鼠SMG类器官在长期传代过程中具有细胞异质性、分化潜力和功能。
原文图1
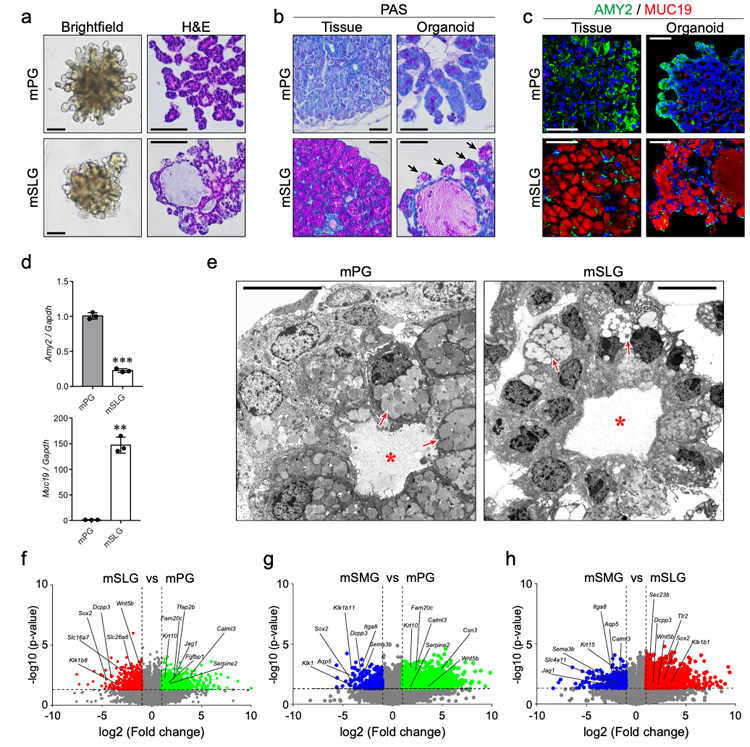
2、研究人员采用与SMG类器官相同的方法生成了小鼠PG和SLG类器官,观察到PG类器官具有呈现树形的小导管,而SLG类器官具有相对较大的囊性管腔。免疫组化结果显示SLG类器官的出芽结构中可检测到pas阳性的黏液细胞及粘蛋白19 (MUC19),而PG类器官中表达淀粉酶2 (AMY2),与唾腺组织中的表达模式一致;超微结构图像显示PG或SLG类器官具有腺泡细胞的浆液或粘液颗粒的明确特征。
进一步比较分析三种主要唾液腺类器官的整体基因表达谱,与唾液腺增殖和功能相关的基因,包括细胞-细胞粘附、离子转运、神经递质转运、肌肉收缩和细胞趋化等,在三种主要的小鼠腺类器官中均差异表达,提示构建的唾液腺类器官在蛋白质和转录物水平上都保留了它们的组织特异性特征。
原文图2
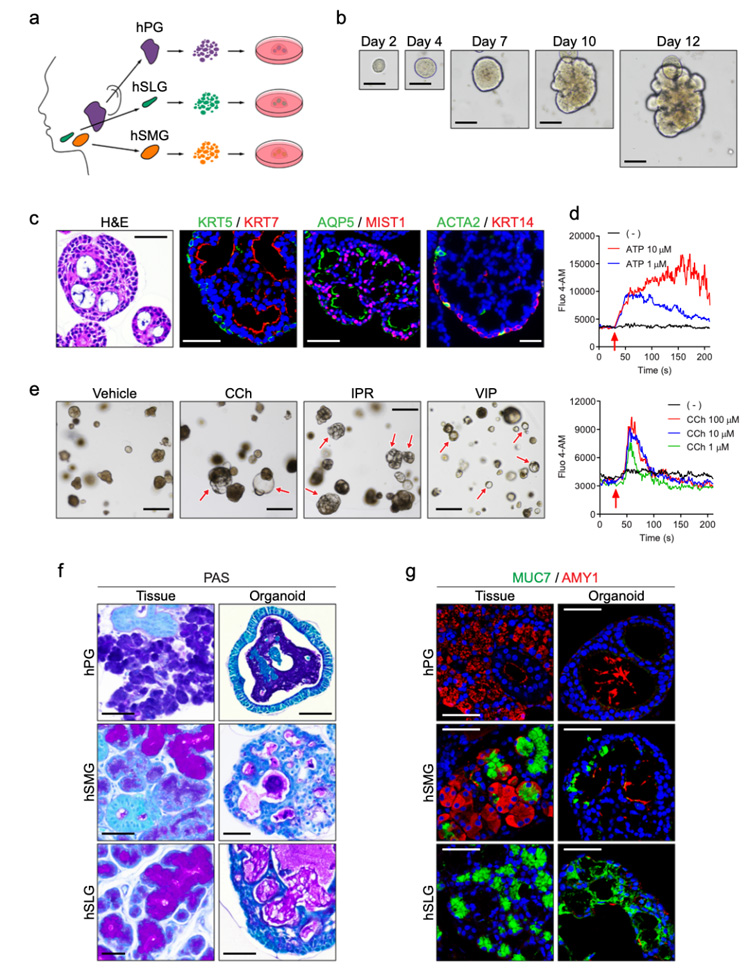
3、基于小鼠唾液类器官的培养体系,研究人员通过添加前列腺素E2等小分子物质对扩增培养基进行调整,成功从人PG、SMG或SLG组织中建立了类器官,可维持4个月的生长和扩增。
分化后, PG、SMG和SLG类器官中出现MIST1+腺泡细胞、ACTA2+KRT14+肌上皮细胞、KRT5+基底和KRT7+管细胞;电镜超微结果显示分泌上皮细胞和肌上皮细胞内存在各种细胞器。类器官经多种神经递质刺激后,显示肿胀表型,表明构建的类器官具有功能性。
此外,为了确定类器官能否再现腺体特异性,研究人员使用PAS染色及相关标志物荧光染色进行评估,结果显示在SMG和SLG中存在黏液阳性的管腔,而在PG类器官中没有;粘蛋白7 (MUC7,粘液腺泡标记物) 在SMG和SLG类器官中表达,而淀粉酶1 (AMY1,人浆液腺泡标记物) 仅在PG和SMG类器官中检测到,与它们在源腺中的表达一致。
这些数据显示人类唾液腺类器官表现出细胞异质性、结构多样性和组织特异性功能。
原文图3
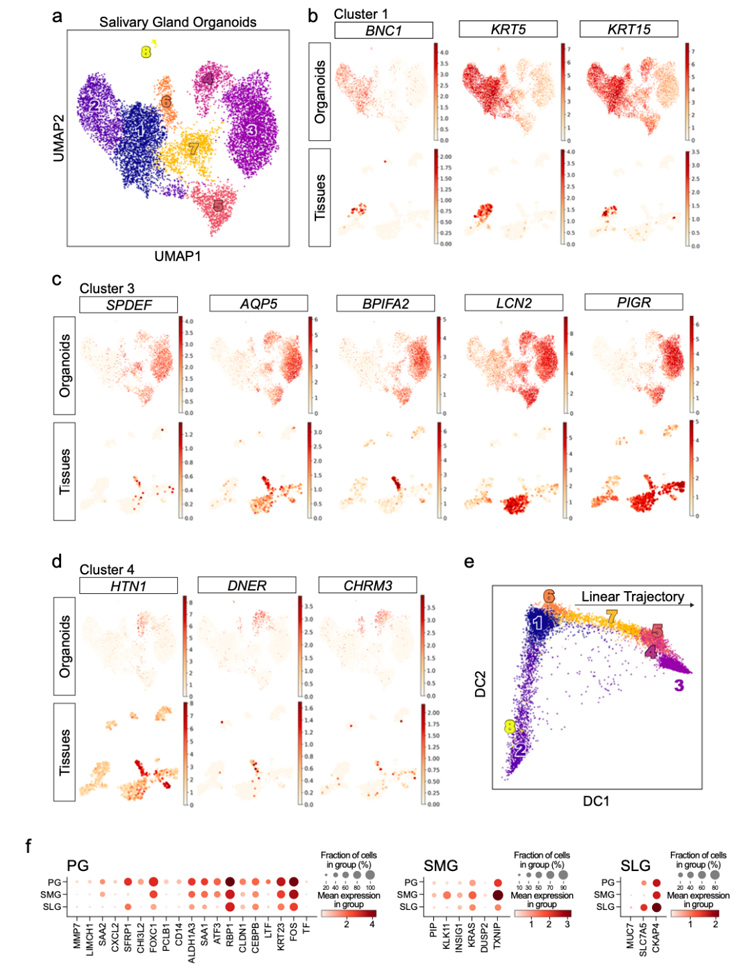
4、将对应的类器官和组织样本进行了单细胞RNA测序,结果显示类器官中存在多种不同细胞组成,其中一些基础的、腔内的、腺泡的或组织特异性标志物在组织和类器官之间很好地保守。
原文图4
5、为探究构建的培养体系是否可以概括不同肿瘤类型的生物学行为,研究人员对来自良性或恶性肿瘤的类器官生长进行了观察,发现来自多形性腺瘤 (PA) 的类器官可持续生长,而来自腺样囊性癌 (AdCC) 或粘液表皮样癌 (MEC) 的类器官 (唾液腺的前价恶性肿瘤)没有生长。
后续研究人员通过降低ALK抑制剂A83-01的浓度改善这一问题。与配对的正常类器官相比,类肿瘤表现出不同的形态学;且肿瘤类器官导管、腺泡和肌上皮细胞标记物的表达与组织相似。同时,构建的不同肿瘤类器官可表现出对nutlin-3的敏感与耐药,且对不同辐射表现出不同的敏感性。
因此,唾液腺肿瘤类器官在预测患者对药物或放射治疗的特异性反应方面具有潜在的应用前景。
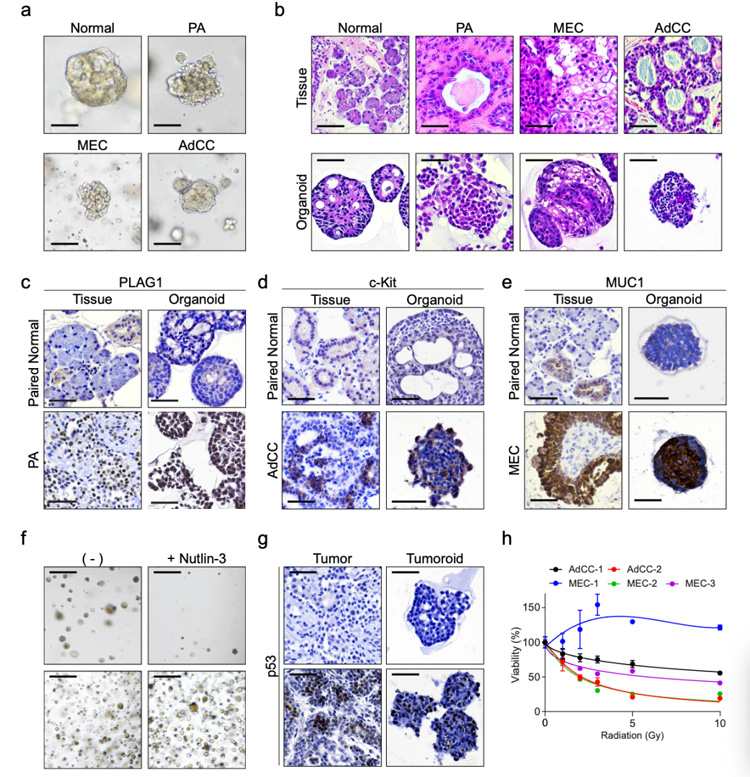
原文图5
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展科研服务CRO、智慧实验室建设和精准医疗三大业务。目前,环特生物已建立多种类器官培养平台,欢迎有需要的读者垂询!
参考文献
[1] Frisch SM, Francis H. Disruption of epithelial cell-matrix interactions induces apoptosis. J Cell Biol 1994; 124: 619-626
[2] Meredith JE, Fazeli B, Schwartz MA. The extracellular matrix as a cell survival factor. Mol Biol Cell 1993; 4: 953-961.
[3] Watanabe K, Ueno M, Kamiya D, et al. A rock inhibitor permits survival of dissociated
human embryonic stem cells. Nat Biotechnol 2007; 25: 681-686.
[4] Sato T, Vries RG, Snippert HJ, et al. Single Lgr5 stem cells build crypt-villus structures in
vitro without a mesenchymal niche. Nature 2009; 459: 262-265.[1] Miletich, I. Introduction to salivary glands: structure, function and embryonic development. Front. Oral. Biol. 2010, 14: 1-20.
[2] Tucker, A. S. Salivary gland development. Semin. Cell Dev. Biol. 2007, 18: 237-244.
[3] Patel, V. N. & Hoffman, M. P. Salivary gland development: a template for regeneration. Semin. Cell Dev. Biol. 2014, 25: 52-60.
[4] Amano, O., Mizobe, K., Bando, Y. & Sakiyama, K. Anatomy and histology of rodent and human major salivary glands-overview of the japan salivary gland society-sponsored workshop-. Acta Histochem. Cytochem. 2012, 45: 241-250.
[5] de Paula, F. et al. Overview of human salivary glands: highlights of morphology and developing processes. Anat. Rec. 2017, 300: 1180-1188.
[6] Diao J. M. et al. Sweat gland organoids contribute to cutaneous wound healing and sweat gland regeneration. Cell Death Dis. 2019, 10: 238.
[7] Bannier-Helaouet, M. et al. Exploring the human lacrimal gland using organoids and single-cell sequencing. Cell Stem Cell 2021, 28: 1221-1232.
[8] Xu, Q. L. et al. Induction of salivary gland-like cells from dental follicle epithelial cells. J. Dent. Res. 2017, 96: 1035-1043.
[9] Shin, H. S. et al. Functional spheroid organization of human salivary gland cells cultured on hydrogel-micropatterned nanofibrous microwells. Acta Biomater. 2016, 45: 121-132.