业务咨询

![]() 发布时间:2023-12-14
发布时间:2023-12-14
![]() 环特生物
环特生物
![]() 浏览次数:3330
浏览次数:3330

编者按
类器官技术自问世以来,推动了人体器官发育、疾病和精准医疗相关研究的进度。人源的肺、胃、肝、肾和前列腺等正常和癌类器官构建方法相继被系统的建立起来,截至本文发稿前,人乳腺正常和癌类器官的构建方法还没有被系统的描述过。
今天我们回顾一项于2021年3月10日发表在《Nature Protocols》的研究——《Long-term culture, genetic manipulation and xenotransplantation of human normal and breast cancer organoids》。作者系统描述了人乳腺正常和癌类器官构建、传代和冻存方法,并介绍了基于类器官的基因操作和异种移植。作者成功构建起包含人乳腺正常和癌类器官共45例的生物库,总结了乳腺类器官构建、传代的特点和类器官的形态特征,并进一步鉴定了正常类器官的细胞群体组成。
一、研究背景
乳腺癌(breast cancer, BC),是女性群体中常见的高发癌症之一,致死率在众多恶行肿瘤中排名第二。由于上皮细胞的突变积累,乳腺癌包含多种亚型,具有较强的生物异质性。
目前临床的治疗手段选择主要基于患者的临床和病理特征结合雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)的表达状况,因此无法充分适应个别患者的需求。而基于类器官技术构建起来的人乳腺正常和癌类器官为研究乳腺的器官发育、肿瘤发生和治疗方案筛选提供了一种具有潜力的体外模型。
二、主要研究成果
1、人乳腺正常和癌类器官构建、基因操作和异种移植方法搭建
作者首先系统描述了人乳腺正常和癌类器官构建、基因操作和异种移植的具体步骤以及注意事项。
在类器官构建部分,主要流程涉及到合格样本组织的获取、 组织处理及消化、类器官构建、类器官传代与冻存。在基因操作部分,作者介绍了3种转染方法,分别是:阳离子脂质体法、电转法和慢病毒包装法,转染后经过抗性筛选和克隆挑选,获得转染后的类器官。在异种移植部分,作者经过类器官扩增并收集形态完整的类器官,小鼠经提前皮下植入雌激素缓释片后原位注射类器官,一段时间后可观察到肿瘤形成。
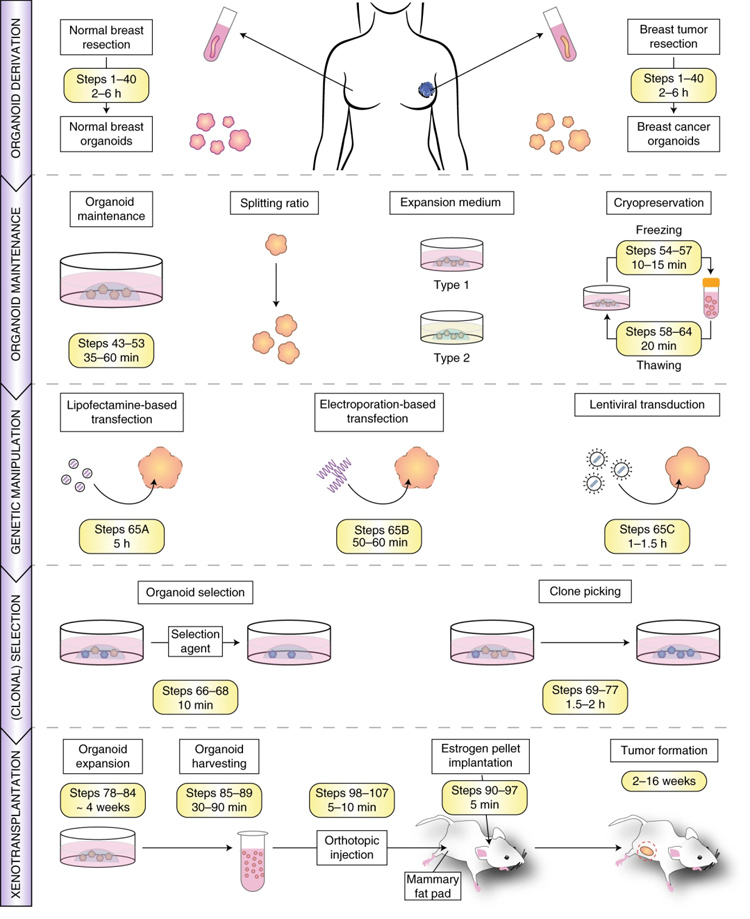
原文图1 人乳腺正常和癌类器官构建、基因操作和异种移植概览图
2、类器官的构建和传代
作者针对人乳腺标本可能存在的脂肪层较厚的情况,指出在样本处理时可先除去脂肪层,以免影响后续的消化效果。脂肪层区别于质地较硬的肿瘤组织,呈现质软,颜色由白色到黄色不等的外观特征,可较轻松的分离除去。
消化体系作者选择胶原酶添加Rock抑制剂-Y27632,在将组织切碎到0.5-1毫米见方的基础上,正常组织消化2h,肿瘤组织消化0.5-2 h,至少每30 min观察取出消化混合物镜检观察,消化结果以5-20个细胞组成的细胞团为好,消化终点用加入胎牛血清终止消化。过筛步骤作者建议反复过滤筛上截留组织碎块至少3次,以增加细胞得率。种胶密度作者推荐,离心后在15 mL离心管底部形成的细胞沉淀厚度约为50 µL液体高度时,添加200 µL胶。若选择12 孔板种胶,每孔种入100 µL胶,点成5-8个胶滴。倒置在孵箱内固化可以减少大的细胞团沉底贴壁的风险。胶固化后,每孔加入培养基750-1000 µL。作者推荐新构建的样本同时使用两种扩增培养基以确定最佳培养条件(详见原文)。
乳腺类器官生长较慢,一般需要2-3 周才能生长至汇合状态,作者推荐传代比1:2,以细胞团状态传代为好。
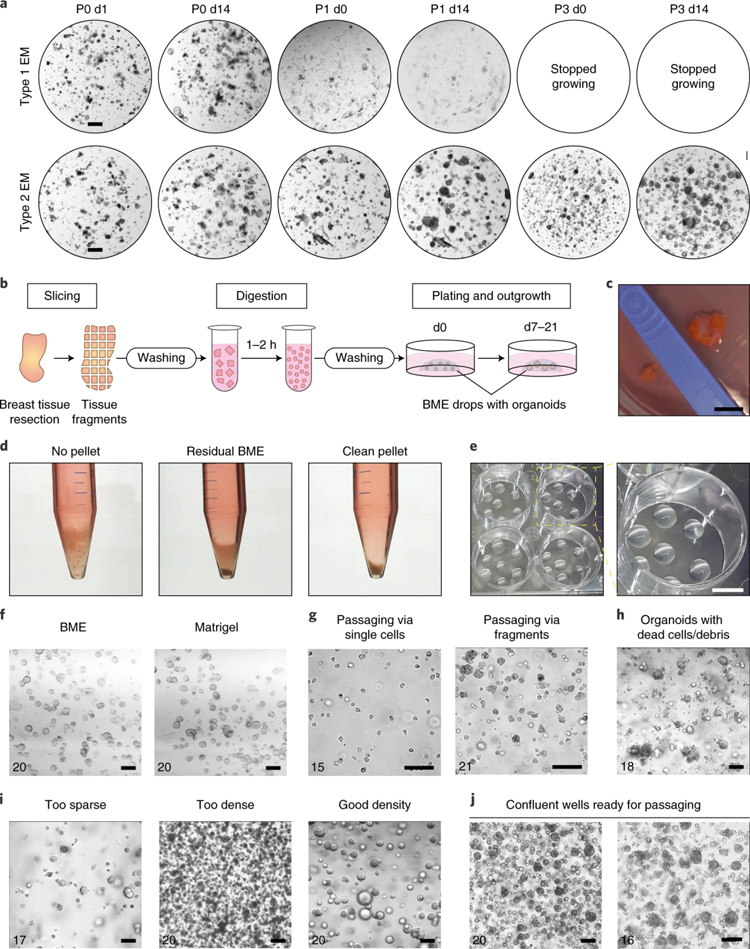
原文图2 类器官的构建、培养和传代
3、乳腺癌类器官的鉴定
作者指出,乳腺癌类器官培养成功率约在55%-70%,不同分型的乳腺癌样本培养成功率有差异,成功率最低的时是三种受体(ER、PR、HER2)表达阴性的分型,只有40%左右。长成后的癌类器官在形态上呈现出实质(约占60%)、葡萄串样(约占20%)、囊泡状(约占5%以下)和混合状(约占20%),大小均能长到100 µm左右。不同患者来源的类器官生长速度差异较大,最慢的会有4周1:2传代,最快的甚至可以达到每周1:6传代。
在病理染色时,作者发现约20%的类器官长成后会出现和亲本组织无法对应的受体表达丢失或受体表达获得,作者猜测可能和培养基中某些因子诱导的突变有关。
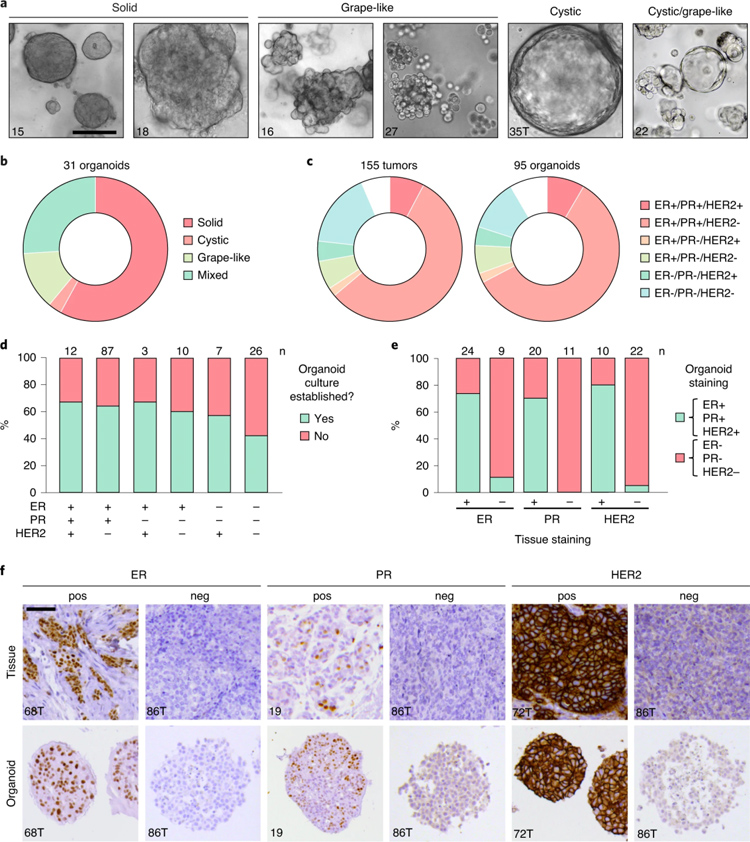
原文图3 乳腺癌类器官的鉴定
4、人乳腺正常类器官的形态特征和细胞组成
作者表明,正常乳腺类器官构建成功率较高,几乎都能构建起来,但后期生长速度慢,最快约每两周1:2传代,且潜力有限,容易在培养过程中状态变差死亡。
长成的人乳腺正常类器官大致有三种形态:成熟的管腔状(ML)、小空泡的管腔祖细胞(LP)和有芽和分支结构的基底细胞(Basal),不同形态的类器官代表了不同的细胞群体,质谱流式结果 也证实了不同细胞群体分布在类器官中。作者还给出了某些关键因子的调整可以带来细胞群体比例变化的结果。
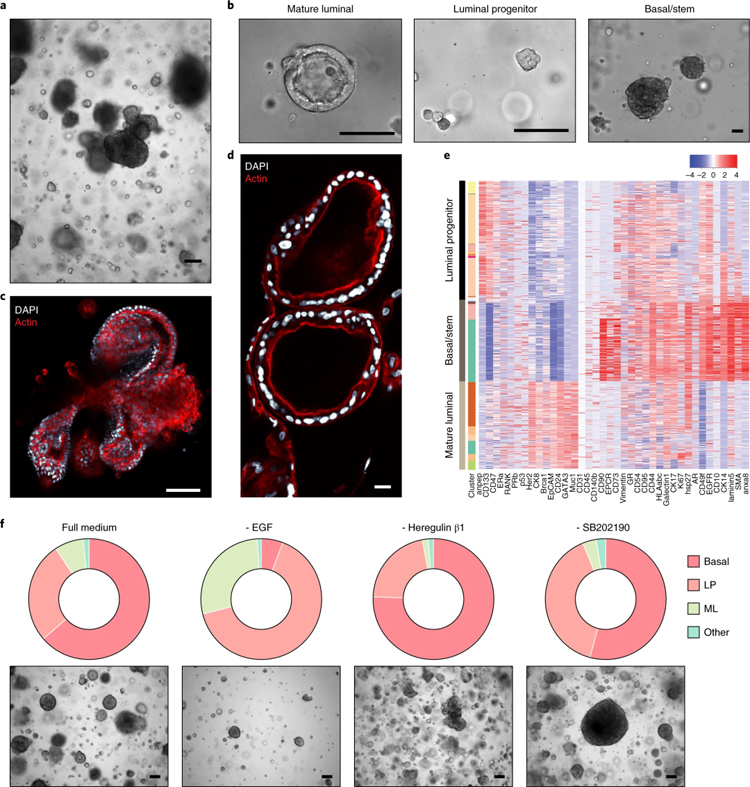
原文图4 正常乳腺类器官的形态及其细胞构成
5、对人乳腺正常类器官的基因操作
作者利用三种方法转染正常类器官:分别是阳离子脂质体法、电转法和慢病毒包装法。在转染操作中,作者推荐使用10万-20万细胞,并尽量消化成单细胞状态,种回胶滴时使用正常传代密度2倍左右的高密度种胶,转染后通过荧光表达评价结果,并利用抗性筛选优化转染后类器官的密度。
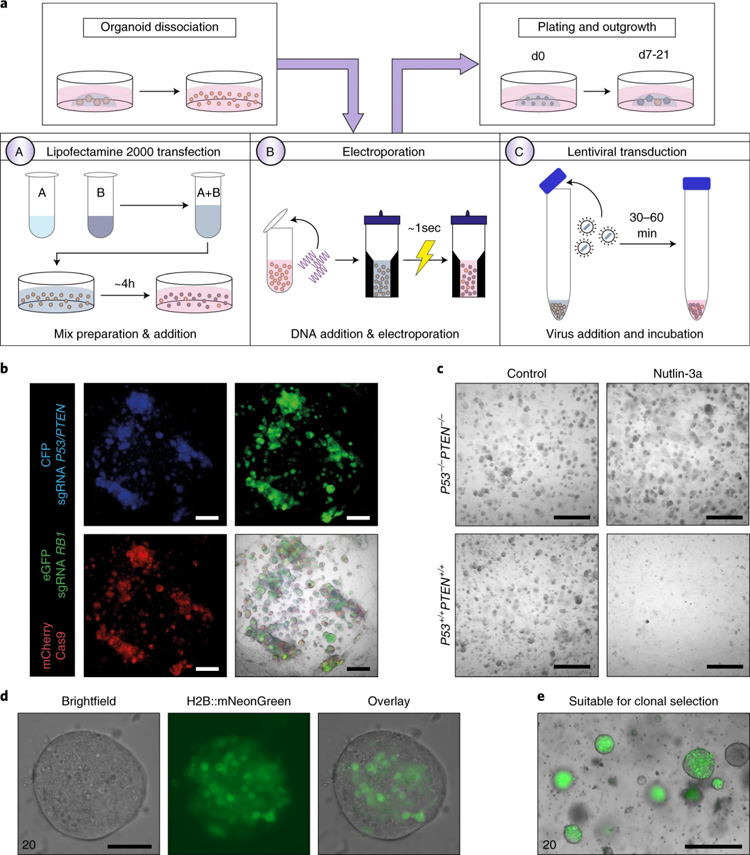
原文图5 对正常类器官的基因操作
6、肿瘤类器官的异体移植
作者推荐使用每百万细胞注射一个位点,且在收获类器官时尽量保证类器官的形态完整。小鼠预先皮下植入雌激素缓释片,以提供促进肿瘤植入和生长的外源性雌激素来源,收获的类器官通过原位注射方式移植到小鼠体内,一段时间后观察成瘤情况。作者还通过在移植液中注入台盼蓝,然后进行解剖,以确定其在乳腺垫中的定位。
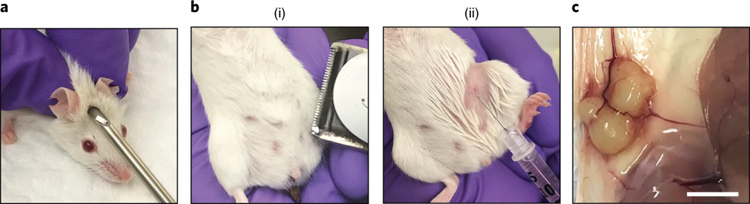
原文图6 人乳腺癌类器官的异体移植
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展科研服务CRO、智慧实验室建设和精准医疗三大业务。目前,环特生物已建立多种类器官培养平台,欢迎有需要的读者垂询!
参考文献
[1] Choi JE, et al. Korean Breast Cancer Society. Breast Cancer Statistics in Korea, 2019. J Breast Cancer. 2023 Jun;26(3):207-220.
[2] Nik-Zainal S, et al. Landscape of somatic mutations in 560 breast cancer whole-genome sequences. Nature. 2016 Jun 2;534(7605):47-54.
[3] Curtis C, et al. The genomic and transcriptomic architecture of 2,000 breast tumours reveals novel subgroups. Nature. 2012 Apr 18;486(7403):346-52.
[4] Rios AC, et al. Intraclonal Plasticity in Mammary Tumors Revealed through Large-Scale Single-Cell Resolution 3D Imaging. Cancer Cell. 2019 Apr 15;35(4):618-632.e6.
[5] Tan PH, et al. WHO Classification of Tumours Editorial Board. The 2019 World Health Organization classification of tumours of the breast. Histopathology. 2020 Aug;77(2):181-185.
[6] Sato T, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 2009 May 14;459(7244):262-5.