业务咨询

![]() 发布时间:2024-01-19
发布时间:2024-01-19
![]() 环特生物
环特生物
![]() 浏览次数:3510
浏览次数:3510

编者按
胶质母细胞瘤是成人中发病率最高的原发性恶性脑肿瘤[1],尽管进行了许多临床试验,但结果不尽人意,导致其不良试验结果的原因可能是肿瘤之间和肿瘤内部存在的分子异质性[2-6]。这种异质性和开发新模型以测试胶质母细胞瘤的个性化治疗策略,仍然是临床前和临床面临的挑战。
建立克隆肿瘤细胞培养和PDX模型对了解胶质母细胞瘤发病的生物学机制做出了巨大贡献,但二者所需的漫长时间阻碍了它们用于测试个性化疗法的临床适用性。然而,已经开发的3D类器官培养系统,可以捕获在各种器官中发现的表型和分子异质性,包括脑类器官[7]。为了研究胶质母细胞瘤,人们对脑类器官组织进行了基因操作,使其具有致癌特性,或与肿瘤球共同培养,以模拟肿瘤细胞侵袭[8-11]。
今天,我们特别关注一项发表在《Cell》的研究——《A Patient-Derived Glioblastoma Organoid Model and Biobank Recapitulates Inter- and Intra-tumoral Heterogeneity》,该研究报告了一种无需单细胞解离、在特定培养基中直接从新鲜肿瘤标本快速生成胶质母细胞瘤类器官(GBOs)的可靠方法,并对生成的GBOs活体生物库进行了全面的组织学、分子学和基因组学分析,结果表明GBOs再现了肿瘤间和肿瘤内的异质性,并保留了其相应亲代肿瘤的许多关键特征。这些GBO可以有效地异种移植到成年小鼠脑部,表现出快速和侵袭性浸润,并保持关键驱动突变的表达。
研究人员还进一步证明,GBOs可用于在临床相关的时间尺度上测试对标准治疗和靶向治疗的反应,包括临床试验药物和嵌合抗原受体T细胞(CAR-T)免疫疗法。综上,这些结果突显了源自患者的胶质母细胞瘤类器官模型和生物库在基础研究、转化研究和个性化疗法测试中的潜在作用。
论文翻译:虞奇芬
01、主要研究成果
1、来自患者肿瘤的胶质母细胞瘤类器官的培养和储存
为了保留原始肿瘤的局部细胞结构和细胞间的相互作用,用细解剖剪将组织剪成直径为1 mm的小块后放入GBO培养基中进行轨道摇床培养,一般在1-2周内形成圆形类器官。H&E染色结果显示GBO均保留了高级别胶质瘤的特征,显示出患者肿瘤的细胞和核异型性,通常包含丰富的有丝分裂象和多形性核,还保留了CD31脉管系统。
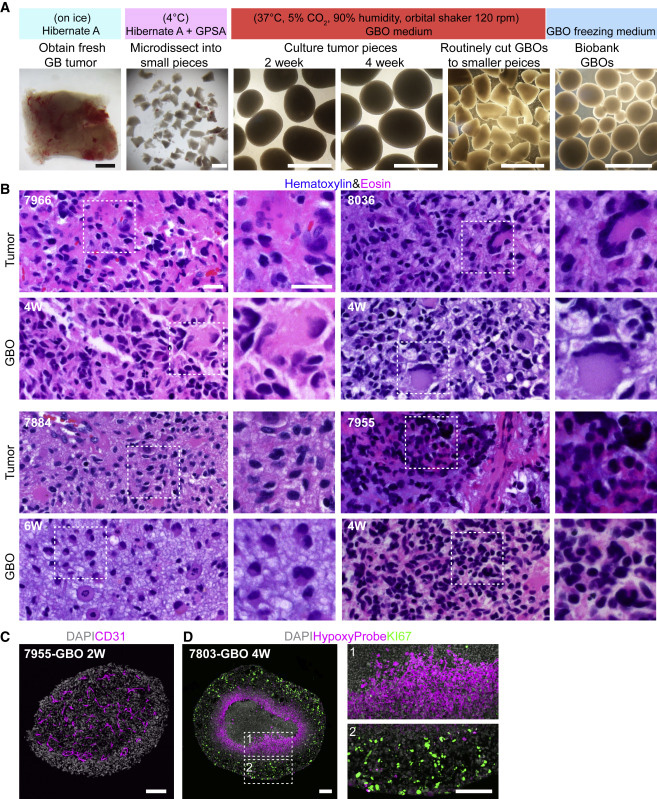
图1
GBOs的细胞特征和形态与相应亲代肿瘤的细胞组成相似,表现出明显的瘤间异质性。对8个肿瘤样本进行的定量分析显示,亲代肿瘤和相应的GBOs中表达SOX2和OLIG2的细胞比例相似,持续时间长达4周。根据KI67免疫染色定量,GBOs在很大程度上保持了相应亲代肿瘤的增殖率,用5-乙炔基-2′-脱氧尿苷(EdU)对GBO进行脉冲标记,1小时后大部分EdU细胞为NESTIN、S100B、DCX或OLIG2,显示了这些GBO中正在活跃分裂的祖细胞亚型。
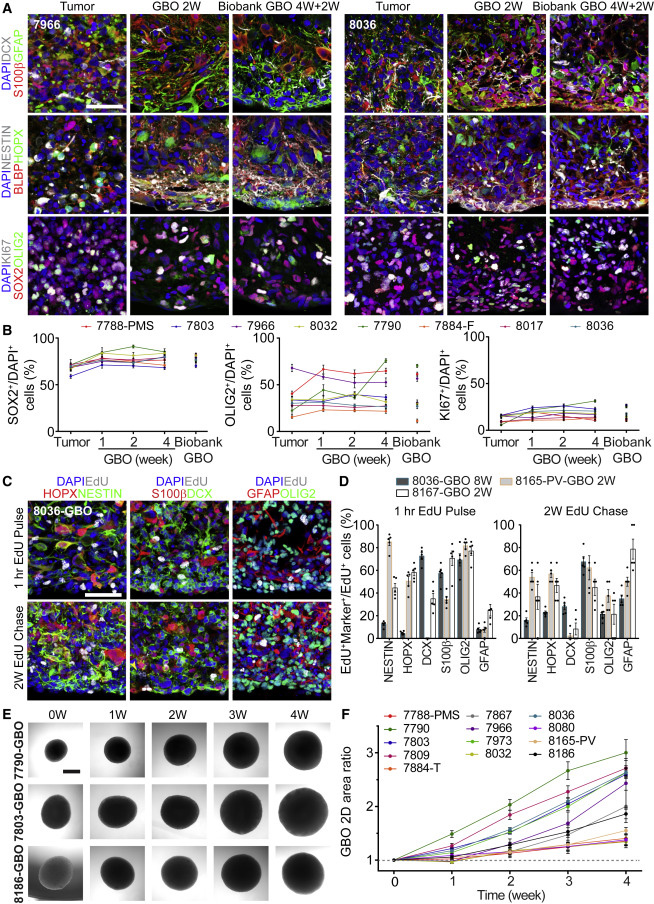
图2
2、通过GBO维持分子和突变在肿瘤间和肿瘤内的异质性
通过对多名患者的大量RNA测序(RNA-seq)进行转录组分析,表明GBOs与其相应亲代肿瘤的全转录组比较显示出高度的相似性。胶质母细胞瘤的瘤间异质性很大,单个亲代肿瘤具有独特基因表达特征,相应的GBO在培养过程中随着时间的推移保持了这些基因表达模式。
通过胶质母细胞瘤基因组学综合研究表明,在亲代肿瘤中发现的大多数体细胞变异都以相似的等位基因频率出现在相应的GBOs中。基因表达分析也显示,GBOs保持了亚区肿瘤样本的特征,通过RNA-seq、PCR及免疫组织学检测到功能增益型表皮生长因子受体变体III(EGFRvIII)在UP-7788肿瘤的不同亚区(ANT和PMS)和相应的GBO中的不同表达。
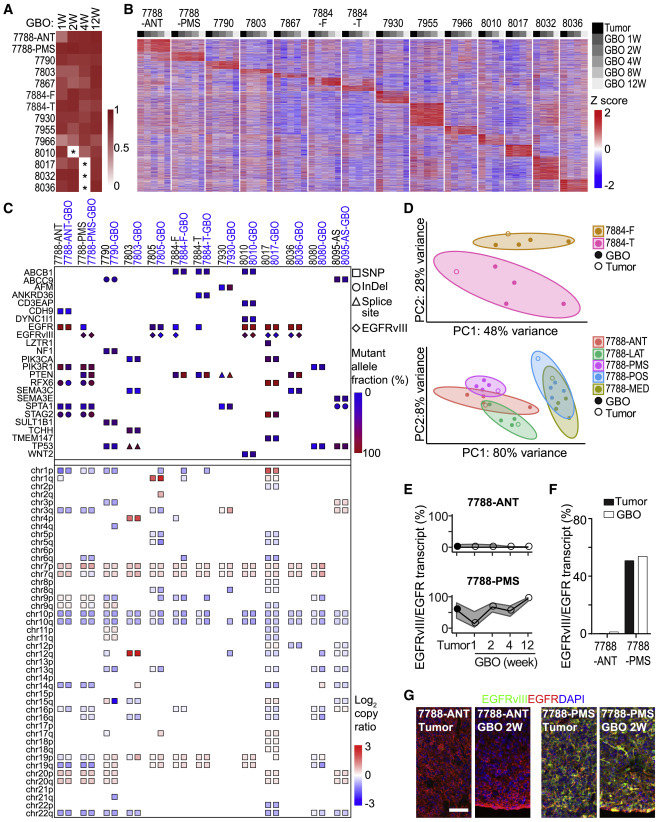
图3
3、异种移植后GBO的强接种和积极渗透
将完整的GBO移植到成年免疫缺陷小鼠大脑中,移植2个月后,通过H&E染色对异种移植的UP-7788-PMS和UP-7790 GBO进行分析,发现原始异种移植部位和浸润区域的组织结构与相应亲代肿瘤相似。对人类特异性抗原HuNu和STEM121的免疫组织学检查证实了GBO衍生细胞在同侧和对侧广泛浸润。
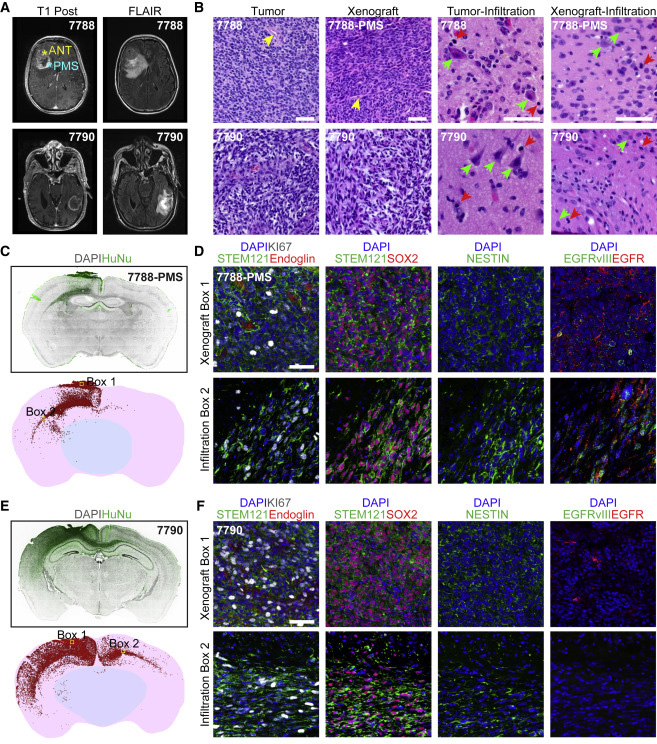
图4
4、利用GBOs建立个性化CAR-T免疫疗法模型
为了评估保持细胞异质性和内源性表皮生长因子受体(EGFR)vIII表达的GBO模型在测试胶质母细胞瘤新兴免疫疗法中的效用,将GBO与2173BBz CAR-T细胞共同培养,设计用于与EGFR vIII的细胞发生特异性反应,CD19和2173BBz CAR-T细胞都侵入了所有GBO,但只有当2173BBz CAR-T细胞与EGFRvIII GBO一起培养时,才观察到CAR-T细胞的明显扩增。这表现为CD3 T细胞的增加,其中许多是GBO内的KI67。
伴随着CAR-T细胞扩增的是GBO中裂解的天冬酶-3信号的增加和EGFRvIII/EGFR信号强度比的降低,这表明EGFR vIII细胞被2173BBz CAR-T细胞靶向并杀死。这些结果证明了GBOs在快速检测抗原特异性CAR-T细胞对培养物中内源性靶点的治疗反应方面的实用性。
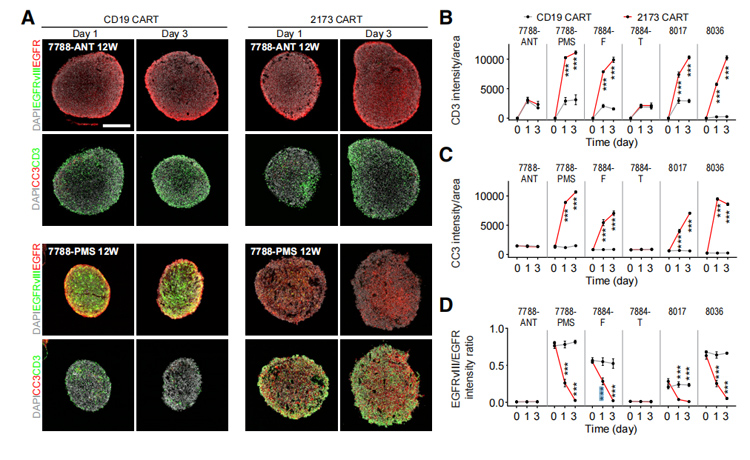
图5
02、编者点评
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特类器官平台已成功搭建多种肿瘤及正常类器官的培养平台,欢迎有需要的读者垂询!
参考文献
[1] Quinn,T,Ostrom,et al.CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2011-2015.[J].Neuro-oncology, 2018.
[2] Paolillo M , Boselli C , Schinelli S .Glioblastoma under Siege: An Overview of Current Therapeutic Strategies[J].Brain Sciences, 2018, 8(1).
[3] Darmanis S , Sloan S A , Croote D ,et al.Single-Cell RNA-Seq Analysis of Infiltrating Neoplastic Cells at the Migrating Front of Human Glioblastoma[J].Cell Reports, 2017, 21(5):1399.
[4] Neftel C , Laffy J , Filbin M G ,et al.An Integrative Model of Cellular States, Plasticity, and Genetics for Glioblastoma[J].Cell, 2019, 178(4).
[5] Single-cell RNA-seq highlights intratumoral heterogeneity in primary glioblastoma.[J].Science, 2014.
[6] Mandel J J , Yust-Katz S , Patel A ,et al.Inability of positive phase II clinical trials of investigational treatments to subsequently predict positive phase III clinical trials in glioblastoma[J].Neuro-oncology, 2017.
[7] Clevers H .Modeling Development and Disease with Organoids[J].Cell, 2016.
[8] Shan B , Marko R , Zhenming G ,et al.Genetically engineered cerebral organoids model brain tumor formation[J].Nature Methods, 2018, 15(8):631-639.
[9] Ogawa J , Pao G M , Shokhirev M N ,et al.Glioblastoma Model Using Human Cerebral Organoids[J].Cell Reports, 2018, 23(4):1220-1229.
[10] da Silva, Bárbara, Mathew R K , Polson E S ,et al.Spontaneous Glioblastoma Spheroid Infiltration of Early-Stage Cerebral Organoids Models Brain Tumor Invasion.[J].Slas Discovery Advancing Life Sciences R & D, 2018.
[11] Linkous A , Balamatsias D , Snuderl M ,et al.Modeling Patient-Derived Glioblastoma with Cerebral Organoids[J].Cell Reports, 2019, 26(12):3203-3211.e5.